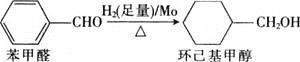
题目内容
【题目】某化学兴趣小组在实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2并完成相关性质探究(不考虑水蒸气)。
(1)有同学认为制得的SO2中可能混有杂质,其化学式为___和___,原因是___。
(2)为验证气体成分,兴趣小组同学设计了如图所示装置进行了实验探究。

①为验证并吸收SO2,装置B中加入的试剂为___;装置C中品红溶液的作用是___。
②装置D中加入的试剂为___。
③装置G中可能出现的现象为___。
④装置H的作用为___。
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。
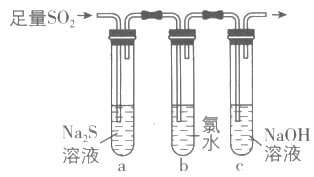
①能验证SO2具有氧化性的实验现象为___;
②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液加入品红溶液,红色褪去;
方案II:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案III:向第三份溶液中加入AgNO3溶液,有白色沉淀生成。
上述方案中合理的是___(填I、II或III);试管b中发生反应的离子方程式为___。
【答案】CO2 H2 铁钉中含C加热条件下会和浓硫酸反应生成CO2;随着反应进行,浓硫酸变稀,铁与稀硫酸反应产生氢气 酸性KMnO4溶液 验证SO2是否吸收完全 澄清石灰水 无水硫酸铜变蓝色 防止空气中H2O进入干燥管而影响杂质气体的检验 a试管中有淡黄色沉淀生成 II Cl2+SO2+2H2O=4H++2Cl-+SO42-
【解析】
(1)铁钉为碳素钢,除铁外还含有C,C也能与浓硫酸反应据此分析;
(2)A装置为发生装置,产生的气体有SO2、CO2、H2,混有水蒸气,根据实验目的逐步进行分析;
(3)实验目的是验证SO2的化学性质,从SO2具有还原性、氧化性、酸性氧化物的角度进行分析。
![]() 碳素钢中含有铁和C等元素,随着反应的进行浓硫酸变稀,会和铁反应生成
碳素钢中含有铁和C等元素,随着反应的进行浓硫酸变稀,会和铁反应生成![]() ,铁钉中有C加热条件下会和浓硫酸反应生成
,铁钉中有C加热条件下会和浓硫酸反应生成![]() ;故答案为:
;故答案为: ![]() ;铁钉中含C加热条件下会和浓硫酸反应生成
;铁钉中含C加热条件下会和浓硫酸反应生成![]() ;随着反应进行,浓硫酸变稀,铁与稀硫酸反应产生氢气;
;随着反应进行,浓硫酸变稀,铁与稀硫酸反应产生氢气;
![]() 根据(1)的分析,可能含有的气体是CO2、SO2、H2等,实验目的是验证气体成分,
根据(1)的分析,可能含有的气体是CO2、SO2、H2等,实验目的是验证气体成分,
①B装置验证并吸收SO2,装置B的作用是验证并吸收SO2,即试剂为KMnO4溶液,装置C中品红溶液的作用是验证SO2是否完全被吸收;若![]() 被吸收完全,装置C中品红溶液不褪色;
被吸收完全,装置C中品红溶液不褪色;
②装置D中加入澄清石灰水,可检验气体中是否有![]() ;
;
③装置E中浓硫酸可干燥气体,装置F中CuO与![]() 反应生成
反应生成![]() ,G中无水硫酸铜吸收水后变蓝;
,G中无水硫酸铜吸收水后变蓝;
④空气中含有水蒸气,对H2还原CuO产物的验证产生干扰,装置H的作用是防止空气中![]() 进入干燥管而影响杂质气体的检验;
进入干燥管而影响杂质气体的检验;
故答案为: ![]() 酸性
酸性![]() 溶液;验证
溶液;验证![]() 是否吸收完全;
是否吸收完全;![]() 澄清石灰水;
澄清石灰水;![]() 无水硫酸铜变蓝色;
无水硫酸铜变蓝色;![]() 防止空气中
防止空气中![]() 进入干燥管而影响杂质气体的检验;
进入干燥管而影响杂质气体的检验;
(3)![]() 和
和![]() 发生氧化还原反应生成S,故a试管中有淡黄色沉淀生成。
发生氧化还原反应生成S,故a试管中有淡黄色沉淀生成。
故答案为:a试管中有淡黄色沉淀生成;
![]() Ⅱ合理,
Ⅱ合理,![]() 被氧化生成
被氧化生成![]() ,和
,和![]() 反应生成白色沉淀,据此能证明
反应生成白色沉淀,据此能证明![]() 的还原性。
的还原性。
故答案为:II;![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】为了更深刻地认识卤素的性质,某化学小组对卤素及其化合物的制备和性质进行如下探究实验,根据实验回答问题。
[实验一]氯气的制备
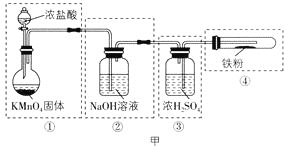
(1)该小组拟用图甲实验装置来制备纯净、干燥的氯气,并完成与金属铁的反应(夹持仪器略去)。每个虚线框表示一个单元装置,请用文字描述将下列装置的错误之处改正:___。
[实验二]探究氯化亚铁与氧气反应的产物
已知氯化亚铁的熔点为674℃,沸点为1023℃;三氯化铁在100℃左右时升华,极易水解。在500℃条件下氯化亚铁与氧气可能发生下列反应:12FeCl2+3O2![]() 2Fe2O3+8FeCl3、4FeCl2+3O2
2Fe2O3+8FeCl3、4FeCl2+3O2![]() 2Fe2O3 +4Cl2,该化学小组选用图乙部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。
2Fe2O3 +4Cl2,该化学小组选用图乙部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。
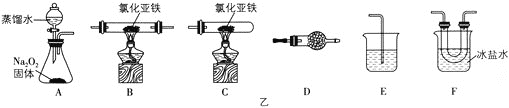
(2)实验装置的合理连接顺序为A→___→E。
(3)简述将装置F中的固体配成溶液的操作方法:___。
[实验三]卤素化合物之间反应的实验条件控制探究
(4)在不同实验条件下KClO3可将KI氧化为I2或KIO3。该小组同学设计的一组实验的数据记录如下表(实验控制在室温下进行):
试管标号 | 1 | 2 | 3 | 4 |
0.20molL-1KI溶液/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4溶液/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①该组实验的目的是___。
②2号试管反应完全后,取少量试管中的溶液,滴加淀粉溶液后显蓝色,假设还原产物只有KCl,写出反应的离子方程式:___。