题目内容
【题目】CO、CO2是化石燃料燃烧后的主要产物。
(1)汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:N2(g)+O2(g)===2NO(g)ΔH=+180.5kJ·mol-1
2C(s)+O2(g)===2CO(g)ΔH=-221.0kJ·mol-1
C(s)+O2(g)===CO2(g)ΔH=-393.5kJ·mol-1
则反应2NO(g)+2CO(g)===N2(g)+2CO2(g)的ΔH=________kJ·mol-1。
(2)已知:反应CO2(g)![]() CO(g)+O(g)在密闭容器中CO2分解实验的结果如图1;反应2CO2(g)
CO(g)+O(g)在密闭容器中CO2分解实验的结果如图1;反应2CO2(g)![]() 2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如图2,
2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如图2,
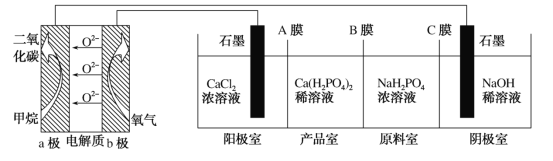
①分析图1,求2min内v(CO2)=_______,5min时达到平衡,平衡时c(CO)=_______。
②分析图2,1500℃时反应达平衡,此时容器体积为1L,则反应的平衡常数K=______(计算结果保留1位小数)。
(3)为探究不同催化剂对CO和H2合成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1:3进行实验,得到如下数据:
选项 | T/K | 时间/min | 催化剂种类 | 甲醇的含量(%) |
A | 450 | 10 | CuO-ZnO | 78 |
B | 450 | 10 | CuO-ZnO-ZrO2 | 88 |
C | 450 | 10 | ZnO-ZrO2 | 46 |
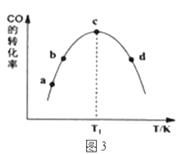
①由表1可知,该反应的最佳催化剂为____________(填编号);图3中a、b、c、d四点是该温度下CO的平衡转化率的是____________。
②有利于提高CO转化为CH3OH的平衡转化率的措施有____________。
A.使用催化剂CuO-ZnO-ZrO2B.适当降低反应温度
C.增大CO和H2的初始投料比D.恒容下,再充入amolCO和3amolH2
【答案】-746.5 3×10-7mol/(L·min) 2×10-6mol/L 3.2×10-8 B cd BD
【解析】
(2)①2min内O的浓度增大0.6×10-6mol/L,则二氧化碳减小0.6×10-6mol/L,根据![]() 计算;
计算;
②建立三段式,根据平衡时,氧气的体积分数为0.2,求算平衡时各物质的平衡浓度,从而计算K值;
(3)①从表1中数据可知,相同条件下甲醇的含量最高时催化剂效果最好,即B;图3中转化率最大值时,即c点,说明反应达到平衡,而ab两点的转化率还在增加,说明反应未达到平衡,;
②由图3可知升高温度平衡逆移,则提高CO2转化为CH3OH平衡转化率,应使平衡向正向移动,可降低温度,增大浓度。
(1) 已知:①N2(g)+O2(g)===2NO(g)ΔH=+180.5kJ·mol-1
②2C(s)+O2(g)===2CO(g)ΔH=-221.0kJ·mol-1
③C(s)+O2(g)===CO2(g)ΔH=-393.5kJ·mol-1
根据盖斯定律,2×③-②-①得反应2NO(g)+2CO(g)===N2(g)+2CO2(g),ΔH=-746.5 kJ·mol-1,故答案为-746.5;
(2)①图1是反应![]() ,2min内
,2min内![]() ;反应变化浓度比等于方程式计量数比,则
;反应变化浓度比等于方程式计量数比,则![]() ,平衡时
,平衡时![]() ;
;
②由图2可知,1500℃时反应达平衡,φ(O2)%=0.2%,此时容器体积为1L,设生成氧气为x mol,建立如下三段式: ,平衡时氧气的体积分数为0.2,则
,平衡时氧气的体积分数为0.2,则![]() ,解得x=0.002,则
,解得x=0.002,则![]() ,则
,则![]() ;
;
(3)①表1数据可知,相同条件下甲醇的含量最高时催化剂效果最好,所以甲醇含量88%最高,催化剂为B:CuO-ZnO-ZrO2最佳;图3中c点的转化率最大,说明反应达到平衡,a、b、c、d四点是该温度下CO平衡转化率的必须是平衡状态下的转化率,ab点反应未达到平衡状态,不是平衡转化率,故cd点是平衡转化率,故答案为:B; cd;
②A.使用催化剂CuO-ZnO-ZrO2加快反应速率,平衡不移动,不能提高转化率,A错误;
B.适当降低反应温度平衡正向移动,可增大转化率,B正确;
C.增大CO和H2的初始投料比,可增大氢气的转化率,一氧化碳的转化率减小,C错误;
D.恒容下,再充入a molCO和3a mol H2,相当于增大压强,平衡正向进行,CO转化率增大,故D正确;
答案为BD。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c