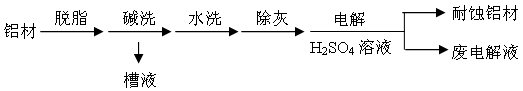
题目内容
下列溶液中有关物质的量浓度关系正确的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合: c(H+) + c(M+) ="=" c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-) +c(OH-) ==c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合: c(H+) + c(M+) ="=" c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-) +c(OH-) ==c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
A
试题分析:A符合电荷守恒的原则。正确。B.当溶液的浓度相等时碱的电量大于盐的水解。而且形成盐的酸的酸性越弱,盐水解的程度就越大。因此pH相等的CH3COONa、NaOH和Na2CO3三种溶液物质的浓度关系是c(NaOH)<c(Na2CO3) <c(CH3COONa)。错误。C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,由于CH3COOH的电离大于CH3COO-的水解程度,所以溶液显酸性。根据电荷守恒可得c(CH3COO-) +c(OH-) ==c(H+) + c(Na+);根据物料守恒可得c(CH3COO-) + c(CH3COOH) =2c(Na+)。两式联立可得c(CH3COO-) +2c(OH-) ==2c(H+) + c(CH3COOH).错误。D.0.1mol·L-1的NaHA溶液,其pH=4,说明HA-的电离作用大于其水解作用。但是无论的电离还是水解程度都是很微弱的。溶液中主要还是以盐的离子形式存在。在溶液中除了HA-的电离还存在水的电离作用,因此c(H+)>c(A2-)。故c(HA-)>c(H+)>c(A2-)>c(H2A)。错误。

练习册系列答案
相关题目