��Ŀ����
����Ŀ�������йػ�ѧ��Ӧ���ʵ�˵����, ��ȷ����
A. l00mL2mol/L��������п��Ӧʱ�������������Ȼ�����Һ���������������ʲ���
B. ����Ƭ��ϡ���ᷴӦ��ȡ����ʱ��������Ƭ��Ũ������Լӿ��������������
C. ����Ƭ��ϡ���ᷴӦ��ȡ����ʱ����������������ͭ��Һ����Ӧ���ʲ���
D. ������N2(g)+3H2(g)![]() 2NH3(g)�����¶ȡ�ѹǿ���䣬����������壬��Ӧ���ʼ���
2NH3(g)�����¶ȡ�ѹǿ���䣬����������壬��Ӧ���ʼ���
���𰸡�D
��������A�������Ȼ�����Һ����Һ�������������Ũ�ȼ�С����Ӧ���ʼ�С��A����B��Ũ�������ǿ�����ԣ����������ۻ������ܲ���������B������C������Ƭ��ϡ���ᷴӦ��ȡ����ʱ����������������ͭ��Һ��п�û���ͭ������ԭ��أ���Ӧ��������C����D�����¶ȡ�ѹǿ���䣬����������壬�����ݻ�����Ӧ��Ũ�ȼ�С����Ӧ���ʼ�����D��ȷ����ѡD��

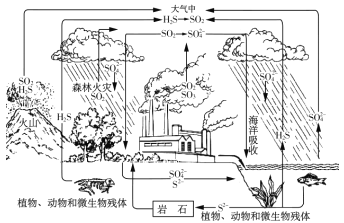
����Ŀ���Ȼ���ͭ��һ����Ҫ�Ļ���ԭ�ϣ��㷺Ӧ�����л��ϳɡ�ʯ�͡���֬��Ⱦ�ϵȹ�ҵ��һ�����õ�Ʒλͭ��(Cu2S��CuS��FeO��Fe2O3��)Ϊԭ����ȡCuCl�Ĺ����������£�
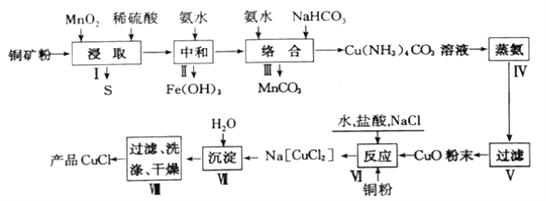
�ش��������⣺
��1����������ȡ��ǰ�轫ͭ������Ŀ����______������ȡ��ʱ����������Ԫ����___(��Ԫ�ط���)��
��2����֪Cu2+��Mn2+��Fe3+��ʼ���ɳ����ͳ�����ȫ��pH���±����������к���ʱ��pHӦ���Ƶķ�ΧΪ_______________��
���� | Cu(OH)2 | Mn(OH)2 | Fe(OH)3 |
��ʼ����pH | 4.7 | 8.3 | 1.2 |
��ȫ����pH | 6.7 | 9.8 | 3.2 |
��֪25��ʱKsp��MnCO3��=2.4��10��11������Ũ��Ϊ1.0��10��5mol/Lʱ����ȫ�������������Mn2+��ȫ����ʱc(CO32��)= ________________��
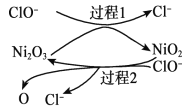
��3������IV������������ʱ������Ӧ�Ļ�ѧ����ʽΪ________________��
��4������VI��Ӧ�����ӷ���ʽΪ______________�������������������ԭ����________________��
��5�����������CuCl�����辭���ˡ�ϴ�ӡ����ϴ��ʱ��������ˮ�Ҵ���������ˮ��ϴ�Ӽ����ŵ���______________(дһ��)��
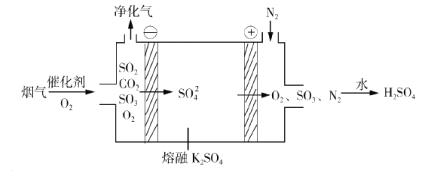
����Ŀ���±��������������෨�����߲�ʱ,����Һ��Ԫ�ص��䷽,���и�ϸ���������ٵ���
���� | K+ | M g2+ | Ca2+ | NO3- | H2PO4- | SO42- | Zn2+ |
����ҺŨ��(mol/L) | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
A. H2PO4-B. SO42-C. Ca2+D. Zn 2+
����Ŀ�������й�ʵ���ͼʾ����������ȷ����
ѡ�� | ʵ��Ŀ�� | ʵ��ͼʾ | ʵ����� |
A | ʵ���������Ը��������Һ�ζ�������Һ |
| ҡƿʱ��ʹ��Һ��һ��������Բ���˶�����ʹƿ�ڽӴ��ζ��ܣ���ҺҲ���ý����� |
B | ʯ�ͷ���ʱ��������� |
| Ϊ�ռ�����ͬ�е㷶Χ��������Ҫ���ϸ�����ƿ�� |
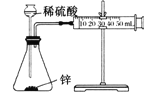
C | �ⶨп��ϡ���ᷴӦ�������������� |
| ʵ���У���ⶨ���������Ƿ�Ӧʱ������������������ |
D | �����Ȼ�̼��ȡ��ˮ�еĵ� |
| ������ã�����Һ�ֲ���Ȱ��ϲ�Һ����Ͽڵ����������²�Һ����¿������� |
A. A B. B C. C D. D