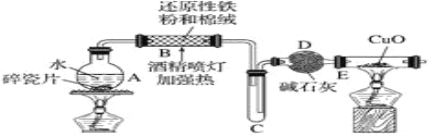
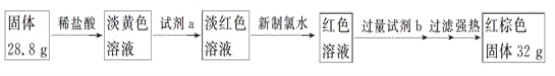
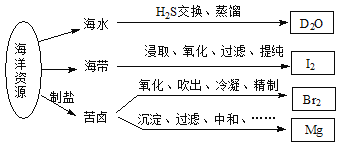
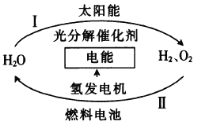
题目内容
【题目】I.(1)下列物质中,属于电解质的是________,(填序号,下同);能导电的是________。
①H2SO4 ②盐酸 ③氯气 ④硫酸钡 ⑤乙醇 ⑥铜 ⑦熔融的NaCl ⑧蔗糖 ⑨空气 ⑩CO2
II. 按要求回答下列问题
(2)硫酸铝(写出电离方程式)_______________。
(3)CuSO4溶液与Ba(OH)2溶液混合(写出离子方程式)_______。
(4)实验室用高锰酸钾制氧气(写化学反应方程式并用单线桥表示电子转移方向和数目)_______。
【答案】①④⑦ ②⑥⑦ Al2(SO4)3=2Al3++3SO42- Cu2++SO42-+Ba2++2OH- = Cu(OH)2↓ + BaSO4↓ 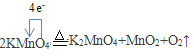
【解析】
(1)①H2SO4不能导电,溶于水能电离出自由移动的氢离子和硫酸根离子,属于电解质;
②盐酸为混合物,溶液中存在自由移动的离子,能导电,混合物既不是电解质也不是非电解质;
③氯气属于非金属单质,不能导电,既不是电解质也不是非电解质;
④硫酸钡是盐,属于电解质,BaSO4固体中没有自由移动的离子,不能导电;
⑤乙醇是非电解质,不能导电;
⑥铜属于金属单质,能导电,既不是电解质也不是非电解质;
⑦熔融的NaCl是盐,属于电解质,熔融的NaCl有自由移动的离子,能导电;
⑧蔗糖是非电解质,不能导电;
⑨空气为混合物,不能导电,既不是电解质也不是非电解质;
⑩CO2是酸性氧化物,属于非电解质,不能导电;
(2)硫酸铝在溶液中电离出铝离子和硫酸根离子;
(3)CuSO4溶液与Ba(OH)2溶液反应生成硫酸钡沉淀和氢氧化铜沉淀;
(4)高锰酸钾受热分解生成二氧化锰、锰酸钾和氧气,反应中生成1mol氧气,氧元素转移4mol电子给锰元素。
(1)①H2SO4不能导电,溶于水能电离出自由移动的氢离子和硫酸根离子,属于电解质;
②盐酸为混合物,溶液中存在自由移动的离子,能导电,混合物既不是电解质也不是非电解质;
③氯气属于非金属单质,不能导电,既不是电解质也不是非电解质;
④硫酸钡是盐,属于电解质,BaSO4固体中没有自由移动的离子,不能导电;
⑤乙醇是非电解质,不能导电;
⑥铜属于金属单质,能导电,既不是电解质也不是非电解质;
⑦熔融的NaCl是盐,属于电解质,熔融的NaCl有自由移动的离子,能导电;
⑧蔗糖是非电解质,不能导电;
⑨空气为混合物,不能导电,既不是电解质也不是非电解质;
⑩CO2是酸性氧化物,属于非电解质,不能导电;
则属于电解质的是①④⑦,能导电的是②⑥⑦,故答案为①④⑦;②⑥⑦;
(2)硫酸铝在溶液中电离出铝离子和硫酸根离子,电离方程式为Al2(SO4)3=2Al3++3SO42-,故答案为Al2(SO4)3=2Al3++3SO42-;
(3)CuSO4溶液与Ba(OH)2溶液反应生成硫酸钡沉淀和氢氧化铜沉淀,反应的离子方程式为Cu2++SO42-+Ba2++2OH- = Cu(OH)2↓ + BaSO4↓,故答案为Cu2++SO42-+Ba2++2OH- = Cu(OH)2↓ + BaSO4↓;
(4)高锰酸钾受热分解生成二氧化锰、锰酸钾和氧气,反应中生成1mol氧气,氧元素转移4mol电子给锰元素,反应的化学方程式和转移电子数目为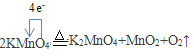 ,故答案为
,故答案为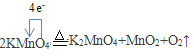 。
。