题目内容
【题目】下列说法正确的是( )
A.0.1 mol?L﹣1的醋酸加水稀释, ![]() 减小
减小
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大
C.体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少
D.常温下,pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合,溶液显碱性
【答案】A
【解析】解:A.醋酸稀释,电离平衡正向移动,醋酸的物质的量减小、醋酸根离子的物质的量增大,则 ![]() 减小,故A正确; B.Kw与温度有关,则向水中加入少量固体硫酸氢钠,c(H+)增大,但Kw不变,故B错误;
减小,故A正确; B.Kw与温度有关,则向水中加入少量固体硫酸氢钠,c(H+)增大,但Kw不变,故B错误;
B.体积、pH均相同的醋酸和盐酸,醋酸浓度大,则完全溶解等量的镁粉(少量)前者反应速率大、用时少,故C错误;
D.常温下,pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合,醋酸浓度大,反应后为醋酸钠和醋酸的混合溶液,则溶液显酸性,故D错误;
故选A.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.

【题目】按要求回答问题
(1)KAl(SO4)2的电离方程式_______________________。
(2)向石蕊试液中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是______________、_________________ (填微粒符号)。
(3)实验室用质量分数为36.5%,密度为1.19g·cm-3的浓盐酸来配制100ml,2mol/L的稀盐酸,需要用量筒量取_______________ml该浓盐酸。
(4)化学方程式H2S+H2SO4(浓)=SO2↑+S↓+2H2O,当生成4.48L(标况) SO2时,转移的电子是__________mol。
(5)下列四个图像中,横坐标表示加入物质的物质的量,纵坐标表示生成沉淀的量或产生气体的量,从A~D中选择符合各题要求的序号填人表中。
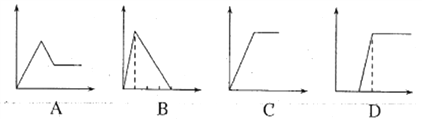
溶液 | 加入的物质 | 序号 |
①AlCl3溶液 | 通入过量的NH3 | ___ |
②Na2CO3和NaOH的溶液 | 滴入过量的盐酸 | ___ |
③NaAlO2溶液 | 滴加稀硫酸至过量 | ___ |
【题目】

(1)该硫酸的物质的量浓度为________________;
(2)实验室用该硫酸配制240mL0.46 mol·L-1的稀硫酸,则
① 需要该硫酸的体积为________mL;
② 有以下仪器: A 烧杯 B 100mL量筒 C 250mL容量瓶
D 500mL容量瓶 E 玻璃棒 F 托盘天平(带砝码)
G 10mL量筒 H 胶头滴管。配制时,必须使用的仪器有______________(填代号);
![]() ③ 配制过程中有几个关键的步骤和操作如下图所示:将上述实验步骤A—F按实验过程先后次序排列。
③ 配制过程中有几个关键的步骤和操作如下图所示:将上述实验步骤A—F按实验过程先后次序排列。
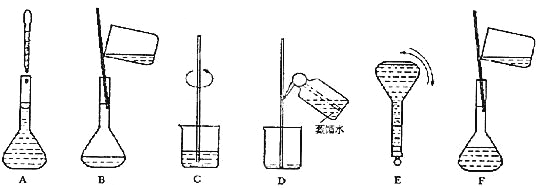
④ 该同学实际配制得到的浓度为0.45 mol·L-1,可能的原因是_________
A.量取浓H2SO4时仰视刻度 | B.容量瓶洗净后未经干燥处理 |
C.没有将洗涤液转入容量瓶 | D.定容时仰视刻度 |



