题目内容
【题目】

(1)该硫酸的物质的量浓度为________________;
(2)实验室用该硫酸配制240mL0.46 mol·L-1的稀硫酸,则
① 需要该硫酸的体积为________mL;
② 有以下仪器: A 烧杯 B 100mL量筒 C 250mL容量瓶
D 500mL容量瓶 E 玻璃棒 F 托盘天平(带砝码)
G 10mL量筒 H 胶头滴管。配制时,必须使用的仪器有______________(填代号);
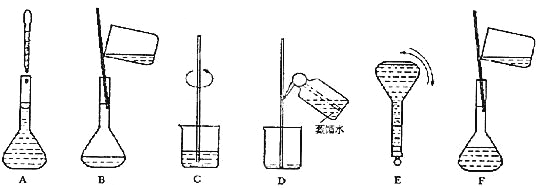
![]() ③ 配制过程中有几个关键的步骤和操作如下图所示:将上述实验步骤A—F按实验过程先后次序排列。
③ 配制过程中有几个关键的步骤和操作如下图所示:将上述实验步骤A—F按实验过程先后次序排列。
④ 该同学实际配制得到的浓度为0.45 mol·L-1,可能的原因是_________
A.量取浓H2SO4时仰视刻度 | B.容量瓶洗净后未经干燥处理 |
C.没有将洗涤液转入容量瓶 | D.定容时仰视刻度 |
【答案】(1)18.4mol/L
(2)①6.3②A C E G H(多选错选不给分,少写1或2个给1分)
③C B D F A E④C D
【解析】试题分析:(1)根据题给信息知该硫酸的密度为1.84g/cm3,质量分数为98%,根据公式c=![]() 计算该该硫酸的物质的量浓度为18.4mol/L ;
计算该该硫酸的物质的量浓度为18.4mol/L ;
(2)①配制240mL0.46 mol·L-1的稀硫酸需用250mL的容量瓶,根据公式c1V1=c2V2计算V2= c1V1/c2=(250×0.46)/18.4=6.3mL;②该实验的实验步骤为:计算、称量、溶解并却、转移、洗涤、定容、摇匀。根据实验步骤确定实验仪器。配制时,必须使用的仪器有ACEGH;③该实验的实验步骤为:计算、称量、溶解并却、转移、洗涤、定容、摇匀。实验步骤按实验过程先后次序排列为CBDFAE。
④ A、量取浓H2SO4时仰视刻度,量取的浓硫酸体积偏大,所配溶液的浓度偏高,错误;B、容量瓶洗净后未经干燥处理,对所配溶液的浓度无影响,错误;C、没有将洗涤液转入容量瓶,溶质损失,所配溶液的浓度偏低,正确;D、定容时仰视刻度,所配溶液的体积偏大,浓度偏低,正确,选CD。

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案