题目内容
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,遇水剧烈水解生成两种气体,常用作脱水剂,其熔点为-105℃,沸点为79℃,140℃以上时易分解。
(1)写出SOCl2吸收水蒸气的化学方程式:_________________
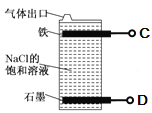
(2)甲同学设计如图所示装置,用ZnCl2·xH2O晶体制取无水ZnCl2、回收SOCl2并验证生成物中含有SO2(夹持及加热装置略)。

①装置的连接顺序为A→B→______→_____→_____。(填字母)
②冷凝管的作用是____________。
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤、冼绦、干燥,称得固体为bg。若![]() =___ (精确至0.1),即可证明ZnCl2·xH2O晶体已完全脱水。
=___ (精确至0.1),即可证明ZnCl2·xH2O晶体已完全脱水。
(3)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验中会发生氧化还原反应。请你设计并简述实验方案判断丙同学的观点:____________。
【答案】 SOCl2+H2O=SO2↑+2HCl↑ D、E、C 把剩余的SOCl2冷凝成液滴,回收 2.1 取少量FeCl3·6H2O于试管中,加入SOCl2,振荡;再往试管中加水溶解,然后滴加BaCl2溶液,若生成白色沉淀则证明脱水过程发生了氧化还原反应(或取少量FeCl3·6H2O于试管中,加入过量SOCl2,振荡;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象则证明脱水过程发生了氧化还原反应)
【解析】(1)二氯亚砜(SOCl2)遇水剧烈水解生成两种气体,根据原子守恒可知气体是氯化氢和二氧化硫,所以SOCl2吸收水蒸气的化学方程式为SOCl2+H2O=SO2↑+2HCl↑。(2)①A中SOCl2吸收结晶水得到SO2与HCl,用冰水冷却收集SOCl2,用品红溶液检验二氧化硫,用氢氧化钠溶液吸收尾气中二氧化硫与HCl,防止污染环境,D装置防止倒吸,则装置的连接顺序为A→B→D→E→C;②二氯亚砜(SOCl2)是一种无色易挥发液体,所以冷凝管的作用是把剩余的SOCl2冷凝成液滴,回收。③ZnCl2xH2O完全脱水得到ZnCl2,则ag为ZnCl2的质量,溶于水后加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg为AgCl的质量,由氯离子守恒可得![]() ,解得b/a=2.1;(3)若发生氧化还原反应,则Fe3+会被还原为Fe2+,而SOCl2水解得到SO2会被氧化为H2SO4,因此实验证明脱水时发生了氧化还原反应方案为:取少量FeCl36H2O于试管中,加入SOCl2,振荡;再往试管中加水溶解,然后滴加BaCl2溶液,若生成白色沉淀则证明脱水过程发生了氧化还原反应,或取少量FeCl36H2O于试管中,加入过量SOCl2,振荡;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象则证明脱水过程发生了氧化还原反应。
,解得b/a=2.1;(3)若发生氧化还原反应,则Fe3+会被还原为Fe2+,而SOCl2水解得到SO2会被氧化为H2SO4,因此实验证明脱水时发生了氧化还原反应方案为:取少量FeCl36H2O于试管中,加入SOCl2,振荡;再往试管中加水溶解,然后滴加BaCl2溶液,若生成白色沉淀则证明脱水过程发生了氧化还原反应,或取少量FeCl36H2O于试管中,加入过量SOCl2,振荡;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象则证明脱水过程发生了氧化还原反应。