题目内容
【题目】按要求回答问题
(1)KAl(SO4)2的电离方程式_______________________。
(2)向石蕊试液中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是______________、_________________ (填微粒符号)。
(3)实验室用质量分数为36.5%,密度为1.19g·cm-3的浓盐酸来配制100ml,2mol/L的稀盐酸,需要用量筒量取_______________ml该浓盐酸。
(4)化学方程式H2S+H2SO4(浓)=SO2↑+S↓+2H2O,当生成4.48L(标况) SO2时,转移的电子是__________mol。
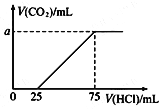
(5)下列四个图像中,横坐标表示加入物质的物质的量,纵坐标表示生成沉淀的量或产生气体的量,从A~D中选择符合各题要求的序号填人表中。
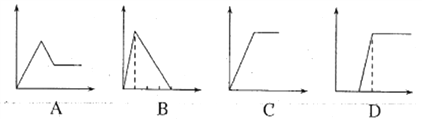
溶液 | 加入的物质 | 序号 |
①AlCl3溶液 | 通入过量的NH3 | ___ |
②Na2CO3和NaOH的溶液 | 滴入过量的盐酸 | ___ |
③NaAlO2溶液 | 滴加稀硫酸至过量 | ___ |
【答案】 KAl(SO4)2 = K++ Al3++2SO42- H+ HClO 16.8 0.4 C D B
【解析】试题分析:(1)KAl(SO4)2在水中电离为K+、 Al3+、SO42-;氯气与水反应生成盐酸和次氯酸,盐酸使石蕊变红、次氯酸具有漂白性使石蕊褪色;(3)根据稀释前后溶质物质的量不变计算配制100ml 2mol/L的稀盐酸需要浓盐酸的体积;(4)根据氧化还原反应的归中规律,H2SO4被还原为SO2;H2S被氧化为S。(5)AlCl3溶液通入过量的NH3,生成氢氧化铝和氯化铵; Na2CO3和NaOH的溶液,滴入过量的盐酸,依次发生的反应是![]() 、
、![]() 、
、![]() ;NaAlO2溶液滴加稀硫酸至过量,依次发生的反应是
;NaAlO2溶液滴加稀硫酸至过量,依次发生的反应是![]() 、
、![]() ;
;
解析:(1)KAl(SO4)2在水中电离为K+、 Al3+、SO42-,电离方程式是KAl(SO4)2 = K++ Al3++2SO42-;氯气与水反应生成盐酸和次氯酸,盐酸使石蕊变红、次氯酸具有漂白性使石蕊褪色,使溶液变红和褪色的微粒分别是H+、 HClO;(3)质量分数为36.5%,密度为1.19g·cm-3的浓盐酸的物质的量浓度是![]() ,设需要浓盐酸的体积是VL, 根据稀释前后溶质物质的量不变,
,设需要浓盐酸的体积是VL, 根据稀释前后溶质物质的量不变, ![]() ,V=0.0168L=16.8mL;(4)根据氧化还原反应的归中规律,H2SO4被还原为SO2;H2S被氧化为S,所以当生成4.48L(标况)SO2时,转移的电子是
,V=0.0168L=16.8mL;(4)根据氧化还原反应的归中规律,H2SO4被还原为SO2;H2S被氧化为S,所以当生成4.48L(标况)SO2时,转移的电子是![]() 。(5)AlCl3溶液通入过量的NH3,生成氢氧化铝和氯化铵,符合图像是C; Na2CO3和NaOH的溶液,滴入过量的盐酸,依次发生的反应是
。(5)AlCl3溶液通入过量的NH3,生成氢氧化铝和氯化铵,符合图像是C; Na2CO3和NaOH的溶液,滴入过量的盐酸,依次发生的反应是![]() 、
、![]() 、
、![]() ,所以符合图像是D;NaAlO2溶液滴加稀硫酸至过量,依次发生的反应是
,所以符合图像是D;NaAlO2溶液滴加稀硫酸至过量,依次发生的反应是![]() 、
、![]() ,所以符合图像是B。
,所以符合图像是B。