题目内容
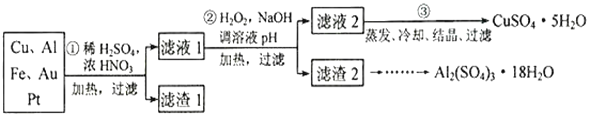
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe 及少量Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:
请回答下列向题:
(1)第①步Cu与酸反应的离子方程式___________________,得到滤渣1的主要成分为_________。
(2)第②步加H2O2的作用是做氧化剂,将溶液中的Fe2+离子氧化为Fe3+,写出该反应的离子方程式_______________________________,用H2O2做氧化的优点是__________________。
(3)滤渣2的主要成分中Al(OH)3和Fe(OH)3在生产中如何分离两种沉淀,写出反应的离子方程式:_____________________________________________。
【答案】Cu+4H++2NO3-=Cu2++2NO2↑+2H2O Au、Pt 2Fe2++H2O2+2H+=2Fe3++2H2O 不引入新的杂质,对环境无污染 Al(OH)3+OH-=AlO2-+2H2O
【解析】
稀硫酸、浓硝酸混合后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,滤渣1的成分是Pt和Au,滤液1中的金属离子是Cu2+、Al3+、Fe2+;过氧化氢具有氧化性,可以氧化亚铁离子为铁离子易于沉淀除去,调节溶液pH目的是铁离子和铝离子全部沉淀,滤渣2的成分为氢氧化铁和氢氧化铝,据此分析解答。
(1)稀硫酸、浓硝酸混合后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,因此第①步Cu与酸反应的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;Au、Pt不能溶于混酸中,则得到滤渣1的主要成分为Au、Pt;
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;过氧化氢做氧化剂还原产物是水,不引入杂质,对环境无污染;
(3)氢氧化铝是两性氢氧化物,则可以用氢氧化钠溶液把Al(OH)3和Fe(OH)3分离,该反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】下列陈述I、Ⅱ正确并且有因果关系的是 ( )
选项 | 表述I | 表述II |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | ClO2有强氧化性 | ClO2可用于自来水消毒 |
C | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
D | NH3·H2O具有碱性 | NH3可使干燥的蓝色石蕊试纸变红 |
A.AB.BC.CD.D