题目内容
【题目】某同学用10mol/L的浓盐酸配制230mL1mol/L的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸___________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有______、______等。
(3)若实验遇下列情况,溶液的物质的量浓度是: ①偏高 ②偏低 ③不变
A、加水定容时越过刻度线_________(填序号)。
B、忘记将洗涤液转入容量瓶__________(填序号)。
C、容量瓶内壁附有水珠而未干燥处理__________ (填序号)。
D、量取的浓盐酸置于烧杯中较长时间后配制__________ (填序号)。
(4)取所配制的稀盐酸100mL,与一定质量的锌充分反应,若锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为______g,设反应后溶液的体积仍为100mL,则反应后溶液中H+的物质的量浓度为_________________。
【答案】 25.0 胶头滴管 250mL容量瓶 ② ② ③ ② 2.6 1.2mol/L
【解析】试题分析:(1)配制230mL1mol/L的稀盐酸,需用250mL的容量瓶,根据稀释前后溶质物质的量不变计算需要量取浓盐酸的体积;
(2)根据配制稀盐酸的步骤分析使用的仪器;(3)根据![]() 分析误差;(4)锌与硫酸反应的化学方程式是
分析误差;(4)锌与硫酸反应的化学方程式是 ![]() ,根据反应方程式计算。
,根据反应方程式计算。
解析:(1)配制230mL1mol/L的稀盐酸,需用250mL的容量瓶,根据稀释前后溶质物质的量不变,设配制250mL1mol/L的稀盐酸需要量取10mol/L浓盐酸的体积是VmL;250mL×1mol/L=10mol/L×VmL,V=25.0mL。
(2)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有250mL容量瓶、胶头滴管等;
(3)A、加水定容时越过刻度线,溶液体积偏大,浓度偏低。B、忘记将洗涤液转入容量瓶,溶质物质的量偏小,浓度偏低。C、容量瓶内壁附有水珠而未干燥处理无影响。D、量取的浓盐酸置于烧杯中较长时间后配制,氯化氢挥发,溶质减少,浓度偏低。
(4)0.896LH2的物质的量是0.04mol,设参加反应的锌的质量为xg,消耗硫酸的物质的量是ymol
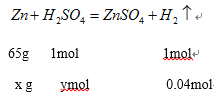
![]() 、
、![]() ,解得x=2.6g,y=0.04mol;
,解得x=2.6g,y=0.04mol;
反应后溶液中H+的物质的量浓度为![]() 。
。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
