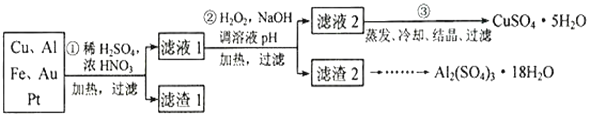
题目内容
【题目】已知反应A+B=C+D的能量变化如图所示(E1、E2均为正值),下列说法正确的是
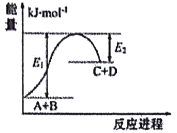
A. 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
B. 该反应只有在加热条件下才能进行
C. A和B的总能量一定高于C和D的总能量
D. 该反应吸收的能量为(E1-E2)
【答案】D
【解析】
A.根据图像,反应物能量低于生成物,说明该反应是吸热反应,所以破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量,故A错误;B.某些吸热反应不需要加热也可以发生,如氢氧化钡晶体和铵盐发生的吸热反应,故B错误;C.根据A的分析可知,该反应是吸热反应,反应物能量低于生成物能量,故C错误;D.△H=断键吸收的能量-成键放出的能量=E1-E2,故D正确;故选D。

练习册系列答案
相关题目
【题目】根据表中信息判断,下列选项正确的是 ( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A. 第①组反应的其余产物只有O2
B. 第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子10 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
【题目】下列试剂中混有的杂质,其除杂试剂和分离操作都正确的是
编号 | 主要成分 | 杂质 | 除杂试剂 | 分离操作 |
A | 铜粉 | 铁粉 | FeCl3溶液 | 过滤 |
B | Na2SO4 | Na2SO3 | 双氧水 | 结晶 |
C | SO2 | HCl | 饱和Na2CO3 | 洗气 |
D | MgO | Al2O3 | 盐酸 | 过滤 |
A. A B. B C. C D. D