题目内容
1.(1)铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3•6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是分解出HCl气体,抑制CeCl3水解(2)Na2S溶液中离子浓度由大到小的顺序为Na+>S2->OH->HS->H+,向该溶液中加入少量固体CuSO4,溶液pH减小(填“增大”、“减小”或“不变”).
(3)已知100℃时水的离子积Kw是1.0×10-12,100℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=7,则NaOH溶液与硫酸溶液的体积比为1:9
(4)25℃在等体积的①pH=0的H2SO4溶液,②0.05mol•L-1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是1:10:1010:109.
分析 (1)氯化铈为强酸弱碱盐,其水溶液为酸性,氯化氢抑制氯化铈水解;
(2)硫化钠为强碱弱酸盐,硫离子水解而使其溶液呈碱性,硫离子有两步水解,第一步水解能力远远大于第二步;硫化铜为难溶于水和酸的物质;
(3)根据$\frac{1{0}^{-3}×{V}_{1}-1{0}^{-4}×{V}_{2}}{{V}_{1}+{V}_{2}}$=10-5计算氢氧化钠和硫酸的体积之比;
(4)根据H20H++OH-可知,H2SO4溶液、Ba(OH)2溶液抑制水的电离,根据溶液的H2SO4溶液的PH或Ba(OH)2溶液中c(OH-)计算水的电离的物质的量,Na2S溶液、NH4NO3溶液促进水的电离,根据PH可直接求出发生电离的水的物质的量,进而计算物质的量之比.
解答 解:(1)氯化铵固体不稳定,在加热条件下易分解生成氯化氢,氯化铈为强酸弱碱盐,氯化铈水解而使其溶液呈酸性,氯化氢能抑制氯化铈水解,所以氯化铵的作用是分解出HCl气体,抑制CeCl3水解,
故答案为:分解出HCl气体,抑制CeCl3水解;
(2)硫化钠为强碱弱酸盐,硫离子易水解而使其溶液呈碱性,硫离子第一步水解能力远远大于第二步,溶液中氢氧根离子来源于水的电离和硫离子水解,硫氢根离子只来源于硫离子水解,但硫离子的水解能力较小,所以溶液中离子浓度大小顺序是Na+>S2->OH->HS->H+,硫化铜不溶于水和酸,硫化氢和硫酸铜反应生成硫化铜黑色沉淀和硫酸,导致溶液酸性增强,则pH减小,
故答案为:Na+>S2->OH->HS->H+;减小;
(3)设氢氧化钠的体积为V1 ,稀硫酸的体积为V2,溶液中$\frac{1{0}^{-3}×{V}_{1}-1{0}^{-4}×{V}_{2}}{{V}_{1}+{V}_{2}}$=10-5,V1 :V2=1:9,故答案为:1:9;
(4)设溶液的体积为1L,
①中pH=0的H2SO4中c(H+)=1.0 mol•L-1,c(OH-)=1.0×10-14mol•L-1,水电离的物质的量为1.0×10-14mol;
②中c(OH-)=0.1 mol•L-1,c(H+)=1.0×10-13mol•L-1,水电离的物质的量为1.0×10-13mol;
③中c(OH-)=1.0×10-4mol•L-1,水的电离的物质的量为1.0×10-4mol;
④中c(H+)=1.0×10-5mol•L-1,水的电离的物质的量为1.0×10-5mol.
故①②③④中水的电离的物质的量之比为:1.0×10-14mol:1.0×10-13mol:1.0×10-4mol1:1.0×10-5mol=1:10:1010:109,
故答案为:1:10:1010:109.
点评 本题考查了盐类水解的应用、酸碱混合溶液的计算,明确盐类水解原理是解本题关键,会根据盐类水解特点来确定溶液中离子浓度大小,强酸弱碱盐和强碱弱酸盐能相互促进水解,题目难度中等.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案| A. | m=Vρa% | B. | c=1000ρaM | C. | c=$\frac{1000m}{VM}$ | D. | a%=$\frac{cM}{1000ρ}$×100% |
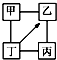 图中“-”表示相连的物质间在一定条件下可以反应,“-→”表示丁在一定条件下可以转化为乙.下面四组选项中,符合图示要求的是( )
图中“-”表示相连的物质间在一定条件下可以反应,“-→”表示丁在一定条件下可以转化为乙.下面四组选项中,符合图示要求的是( )| 甲 | 乙 | 丙 | 丁 | |
| A | H2SO4 | Na2SO4 | NaOH | NaCl |
| B | KCl | K2CO3 | KOH | HCl |
| C | O2 | CO | CuO | C |
| D | Fe | CuCl2 | Zn | HCl |
| A. | A | B. | B | C. | C | D. | D |
| A. | 直径介于1nm~100 nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体带电 | |
| C. | 用盐析法可分离皂化反应后所得的产物 | |
| D. | 用含1mol FeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子 |
| A. | 银氨溶液 | B. | 新制的氢氧化铜 | C. | 溴水 | D. | 氢氧化钠溶液 |
| A. | 向硅酸钠溶液中通入少量CO2气体 SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| B. | 将Cu片插入FeCl3溶液中 Cu+Fe3+═Fe2++Cu2+ | |
| C. | 向烧碱溶液中滴加少量Al2(SO4)3溶液 Al3++4OH-═[Al(OH)4]- | |
| D. | 将Ag丝插入NaNO3和H2SO4的混合液中 3Ag+4H++NO3-═3Ag++NO↑+2H2O |
| A. | 配制一定物质的量浓度的溶液,定容时俯视刻度线 | |
| B. | 测量一包固体的质量,将药品放在右盘,砝码放在左盘,并需移动游码使之平衡 | |
| C. | 中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释 | |
| D. | 在敞口容器中测量氢氧化钠和稀盐酸反应的中和热 |
 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题: