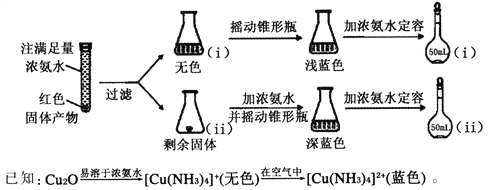
题目内容
【题目】低碳经济是以低能耗、低污染、低排放为基础的经济模式。低碳经济的概念在中国正迅速从高端概念演变成全社会的行为,在新能源汽车、工业节能等多个领域都大有作为。 请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上可利用CO或CO2来制备清洁液体燃料甲醇。已知:800℃时,化学反应①、反应②对应的平衡常数分别为2.5、1.0。
反应①:2H2(g)+CO(g)![]() CH3OH(g) △H = -90.8kJ mol-1
CH3OH(g) △H = -90.8kJ mol-1
反应②:H2(g)+CO2(g)![]() H2O(g)+CO(g) △H= +41.2kJ mol-1
H2O(g)+CO(g) △H= +41.2kJ mol-1
写出用CO2与H2反应制备甲醇的热化学方程式________________________,800℃时该反应的化学平衡常数K的数值为_______________。
现将不同量的CO2 (g)和H2(g)分别通入到容积为2L恒容密闭容器中进行反应②,得到如下二组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO2 (g) | H2(g) | H2(g) | CO2 (g) | |||
1 | 900 | 4 | 6 | 1.6 | 2.4 | 2 |
2 | 900 | a | b | c | d | t |
实验2中,若平衡吋,CO2 (g)的转化率小于H2(g),则a、b必须满足的关系是_________。
若在900℃时,另做一组实验,在此容器中加入10mol CO2,5mol H2,2 mol CO,5 mol H2O (g),则此时v正___v逆(填“>”、“>”或“=”)。
(2)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:CH3OH(g)+CO(g) ![]() HCOOCH3(g) △H=-29.1KJ·mol-1 ,科研人员对该反应进行了研究,部分研究结果如下:
HCOOCH3(g) △H=-29.1KJ·mol-1 ,科研人员对该反应进行了研究,部分研究结果如下:
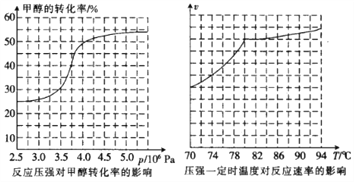
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是____(填“3.5×106 Pa”“4.0×106 Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是______________________。
(3)已知常温下NH3H2O的电离平衡常数K= 1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2 =4. 7×10-11。常温下,用氮水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液呈_____(填“酸性”“中性”或“碱性”),溶液中离子浓度由大到小的顺序为:_________。
【答案】 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.6kJ·mol-1 2.5 a>b > 4.0×106 Pa 高于80 ℃时,温度对反应速率影响较小,又因反应放热,升高温度时平衡逆向移动,转化率降低 碱性 c(NH4+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
CH3OH(g)+H2O(g) △H=-49.6kJ·mol-1 2.5 a>b > 4.0×106 Pa 高于80 ℃时,温度对反应速率影响较小,又因反应放热,升高温度时平衡逆向移动,转化率降低 碱性 c(NH4+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
【解析】(1)反应①:2H2(g)+CO(g)![]() CH3OH(g) △H = -90.8kJ mol-1
CH3OH(g) △H = -90.8kJ mol-1
反应②: H2(g)+CO2(g)![]() H2O (g)+CO(g) △H= +41.2kJ mol-1
H2O (g)+CO(g) △H= +41.2kJ mol-1
用CO2与H2反应制备甲醇的热化学方程式可由①+②求得: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.6kJ·mol-1 ,该反应的平衡常数K=K1K2=2.5×1.0=2.5
CH3OH(g)+H2O(g) △H=-49.6kJ·mol-1 ,该反应的平衡常数K=K1K2=2.5×1.0=2.5
在反应中,当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一反应物越多,其转化率越低,而另一反应物转化率越高,实验2中,若平衡吋,CO2 (g)的转化率小于H2(g),则a、b必须满足的关系是a/b>1/1,即a>b;
CO2(g)+ H2(g)![]() H2O (g)+CO(g)
H2O (g)+CO(g)
n始/mol 4 6
n变/mol 1.6 1.6 1.6 1.6
n平/mol 2.4 4.4 1.6 1.6
另一容器 10 5 5 2
![]() ,此时平衡正向移动,则此时v正>v逆
,此时平衡正向移动,则此时v正>v逆
(2)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率变化最大的是4.0×106Pa。②依据图象分析温度在高于80°C对反应速率影响不大,反应是放热反应,温度过高,平衡逆向进行,不利于转化率增大,故:高于80℃时,温度对反应速率影响较小;且反应放热,升高温度时平衡逆向移动,转化率降低。
(3)已知常温下NH3H2O的电离平衡常数K= 1.75×10-5,大于H2CO3的电离平衡常数K1=4.4×10-7,相当于强碱弱酸盐,碳酸氢根离子的水解能力大于铵根离子水解能力,则碳酸氢铵溶液呈碱性;碳酸氢根离子的水解能力大于铵根离子水解能力,则人c(NH4+)>c(HCO3-),碳酸氢铵溶液呈碱性,c(OH-)>c(H+),所以c(NH4+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。

 阅读快车系列答案
阅读快车系列答案