题目内容
5.电镀废液的综合利用有利于减少重金属对水体的污染.某实验小组用以下流程模拟利用一定量工业电镀废液(强酸性,含Cr2O72-、杂质Cu2+等)制备水溶性皮革鞣剂Cr(OH)SO4.回答下列问题:(已知lg2=0.3,Ksp[Cr(OH)3]=6.4×10-31,Ksp[Cu(OH)2]=2×10-20 )

(1)加Na2SO3前先将废液调为弱酸性溶液的原因是溶液酸性过强,Na2SO3生成SO2,利用率降低,写出废液中加Na2SO3时发生反应的离子方程式Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O.
(2)步骤①须保持温度在30~50℃,可采用的措施是水浴加热.
(3)步骤②的操作名称是过滤、洗涤.
(4)若在步骤②中,使Cr3+完全沉淀,则溶液的pH范围为5.6<pH<6,
(5)粗产品中含有微量CrO42-,工业选择的试剂X应满足的条件是A、D.
A.与水互不相溶 B.CrO42-在X中溶解度小
C Cr(OH)SO4在X中溶解度大 D.Cr(OH)SO4与X不反应
(6)若工业电镀废液含0.1mol Cr2O72-,最终制得产品31.35g,则产率为95%.
(7)酸性条件下,蔗糖还原Na2Cr2O7也可制备Cr(OH)SO4:
Na2Cr2O7+NaHSO4+C12H22O11→Cr(OH)SO4+Na2SO4+H2O+CO2(未配平)
①反应中每生成1molCr(OH)SO4,理论上需要C12H22O11$\frac{1}{16}$mol
②将生成液降温至17℃以下,静置,过滤,在80℃时蒸发滤液,得到标准的工业产品,该产品中混有的主要杂质是Na2SO4.
分析 由流程可知,电镀废液(强酸性,含Cr2O72-,杂质Cu2+等),加入Na2SO3溶液,经过步骤①处理得到溶液A,SO32-可被酸性介质下的Cr2O72-氧化而产生SO42-,加入NaOH溶液经过步骤②处理,产生Cr(OH)3沉淀,过滤出沉淀,加入稀硫酸反应,得到粗产品Cr(OH)SO4,再加入试剂X进行分渣处理,得到纯产品Cr(OH)SO4,和另一部分试剂X和CrO42-的混合溶液,据此分析解答.
解答 解:(1)加Na2SO3前先将废液调为弱酸性溶液,考虑到若为强酸性溶液,则会产生SO2,导致S元素损失,从而Na2SO3的利用率降低,SO32-可以被酸性条件下的Cr2O72-氧化为SO42-,Cr2O72-被还原为Cr3+,反应为氧化还原反应,则反应的离子方程式为:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O,
故答案为:溶液酸性过强,Na2SO3生成SO2,利用率降低;Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O;
(2)步骤①须保持温度在30~50℃,控制温度在此范围内变化,可考虑采用的措施是水浴加热,
故答案为:水浴加热;
(3)步骤②为加入NaOH溶液,使溶液中Cr3+形成Cr(OH)3,和溶液分离,因此操作为过滤,洗涤,得到粗产品,
故答案为:过滤、洗涤;
(4)若在步骤②中,使Cr3+完全沉淀,根据Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=6.4×10-31,当溶液中的c(Cr3+)的离子浓度<10-5mol/L时,可认为Cr3+已经沉淀完全,根据Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)=6.4×10-31,则此时溶液中pH=14+$\frac{1}{3}$lg$\frac{{K}_{sp}[Cr(OH)_{3}]}{c(C{r}^{3+})}$=5.6,当Cr(OH)3达到饱和溶液时,此时溶液中达到平衡时,c(OH-)=3c(Cr3+),则溶液中pH=14+$\frac{1}{4}$lg$\frac{{K}_{sp}[Cr(OH)_{3}]}{27}$=6,所以调控溶液的pH的范围是5.6<pH<6,
故答案为:5.6;6;
(5)粗产品中含有微量CrO42-,加入试剂X的目的是分离出Cr(OH)SO4,因此要求不能与水互溶,CrO42-需要在X中尽可能溶解,Cr(OH)SO4在X中的溶解度不能大,且不能与X反应,符合要求的有A,D,
故答案为:A、D;
(6)若工业电镀废液含0.1mol Cr2O72-,最终制得产品31.35g,产品为Cr(OH)SO4,物质的量为$\frac{31.35g}{165g/mol}$=0.19mol,根据Cr元素守恒,0.1molCr2O72-中含有0.2molCr,则产率为$\frac{0.19mol}{0.2mol}×100%$=95%,
故答案为:95%;
(7)①反应为氧化还原反应,根据反应过程中电子得失守恒,Cr从+6降低为+3,转移3个电子,C从0价升为+4价,转移4个电子,则建立关系8Cr2O72-~~~~~C12H22O11~~~~~16Cr(OH)SO4,所以反应中每生成1molCr(OH)SO4,理论上需要C12H22O11 $\frac{1}{16}$mol,
故答案为:$\frac{1}{16}$;
②将生成液降温至17℃以下,静置,过滤,在80℃时蒸发滤液,得到标准的工业产品,可考虑整个过程中,Na+始终在溶液中,因此判断产品中最有可能混有Na2SO4,且反应产物就有Na2SO4,
故答案为:Na2SO4.
点评 本题考查无机工艺路程,结合流程图,分析每一步加入试剂的反应过程,涉及到溶度积常数有关计算,产率的计算,氧化还原反应的计算,注意本题中元素守恒思想和电子得失守恒的方法的运用,是高频考点,考查综合分析和整体把握能力,题目难度中等.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案| A. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 | |
| B. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| C. | 第二周期元素从左到右第一电离能依次增大 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
 电子表所用的纽扣电池,两极材料为锌和氧化银,电解质溶液为KOH溶液,电池反应为 Ag2O+Zn+H2O═2Ag+Zn(OH)2,示意图如图.下列判断正确的是( )
电子表所用的纽扣电池,两极材料为锌和氧化银,电解质溶液为KOH溶液,电池反应为 Ag2O+Zn+H2O═2Ag+Zn(OH)2,示意图如图.下列判断正确的是( )| A. | 锌为负极,被还原 | |
| B. | 纽扣电池工作时,OHˉ移向Ag2O | |
| C. | 每6.5 g 锌发生反应时,转移电子0.1 NA | |
| D. | 纽扣电池工作时,电解质溶液的碱性增强 |
| 容器 | 温度/K | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | SO2或SO3平衡转化率 | ||
| c(SO2) | c(O2) | c(SO3) | c(SO3) | |||
| Ⅰ | 723 | 0.2 | 0.1 | 0 | 0.16 | α1 |
| Ⅱ | 723 | 0.4 | 0.2 | 0 | α2 | |
| Ⅲ | 823 | 0 | 0 | 0.2 | α3 | |
| A. | 达到平衡时,α1+α3>1 | |
| B. | 达到平衡时,容器中的压强:PⅡ>PⅠ>PⅢ | |
| C. | 达到平衡时,容器Ⅲ中的逆反应速率比容器Ⅰ中的大 | |
| D. | 若起始时,向容器Ⅰ中充入0.16 mol SO2、0.04 mol O2和0.16 mol SO3,则此时反应向逆反应方向进行 |
| A. | 食盐溶解 | B. | 冰融化 | C. | 氯化铵受热分解 | D. | 氧化铝电解 |
| A. | 核外电子是分层运动的 | |
| B. | 所有电子在同一区域里运动 | |
| C. | 能量高的电子在离核近的区域里运动 | |
| D. | 能量低的电子在离核远的区域里运动 |




 .
.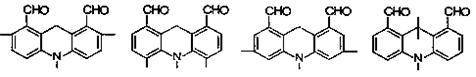 .
. 结构;
结构;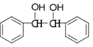 写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)
写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)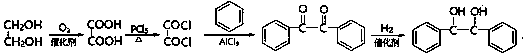 .
.