题目内容
8.下列说法正确的是( )| A. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 | |
| B. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| C. | 第二周期元素从左到右第一电离能依次增大 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
分析 A.ⅥA族元素的氢化物中,O的非金属性最强,且水分子间含氢键;
B.同周期ⅠA族元素的金属性比ⅡA族元素的金属性强;
C.Be最外层2s电子为全满,N的2p电子半满,为稳定结构,第一电离能大于相邻元素;
D.第三周期的阴离子半径大于阳离子半径,且具有相同电子排布的离子中原子序数大的离子半径小.
解答 解:A.ⅥA族元素的氢化物中,O的非金属性最强,且水分子间含氢键,则水最稳定,水沸点最高,故A正确;
B.同周期ⅠA族元素的金属性比ⅡA族元素的金属性强,不同周期时Ca的金属性大于Na的金属性,故B错误;
C.Be最外层2s电子为全满,N的2p电子半满,为稳定结构,第一电离能大于相邻元素,则不能从左到右第一电离能依次增大,故C错误;
D.第三周期的阴离子半径大于阳离子半径,且具有相同电子排布的离子中原子序数大的离子半径小,则铝离子半径最小,故D错误;
故选A.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
18.如图是产生和收集气体的实验装置,该装置最适合于( )


| A. | 用浓硝酸与Cu 反应制取NO2 | B. | 用浓盐酸和 MnO2 反应制取 C12 | ||
| C. | 用 NH4Cl 和 Ca(OH)2 反应制取 NH3 | D. | 用 H2O2溶液和 MnO2 反应制取 O2 |
19.甲醛与单烯烃的混合物中含氧的质量分数为X,则其含碳的质量分数是( )
| A. | $\frac{6(1-x)}{7}$ | B. | $\frac{1-Χ}{7}$ | C. | $\frac{3Χ}{4}$ | D. | 无法计算 |
16.下列离子方程式书写正确的是( )
| A. | 铝粉投入到NaOH溶液中:Al+3OH-═Al(OH)3↓ | |
| B. | 金属钠投入到水中:Na+H2O═Na++OH-+H2↑ | |
| C. | FeCl2溶液中滴加氨水:Fe2++2OH-═Fe(OH)2↓ | |
| D. | 碳酸钡与稀盐酸反应:BaCO3+2H+═Ba2++H2O+CO2↑ |
3. 如图是反应CO(g)+2H2(g)═CH3OH(g)进行过程中的能量变化曲线.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.下列相关说法正确的是( )
如图是反应CO(g)+2H2(g)═CH3OH(g)进行过程中的能量变化曲线.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.下列相关说法正确的是( )
 如图是反应CO(g)+2H2(g)═CH3OH(g)进行过程中的能量变化曲线.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.下列相关说法正确的是( )
如图是反应CO(g)+2H2(g)═CH3OH(g)进行过程中的能量变化曲线.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.下列相关说法正确的是( )| A. | 该反应的△H=+91KJ/mol | |
| B. | 加入催化剂,该反应的△H变小 | |
| C. | 反应物的总能量比生成物的总能量高 | |
| D. | 如果该反应生成液态CH3OH,则△H变大. |
13.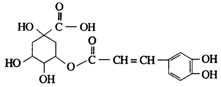 金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )
金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )
 金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )
金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )| A. | 绿原酸的分子式为C16H8O9 | |
| B. | 1个绿原酸分子中含有4个手性碳原子 | |
| C. | 1mol绿原酸最多与4molNaOH反应 | |
| D. | 1mol绿原酸最多能与6molH2发生反应 |
20.当反应N2(g)+3H2(g)?2NH3(g),△H<0达到平衡时,下列措施能提高N2转化率的是( )
①降温
②恒容通入Ne(g)
③增加N2的浓度
④缩小容器的容积.
①降温
②恒容通入Ne(g)
③增加N2的浓度
④缩小容器的容积.
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
17.下列叙述不正确的是( )
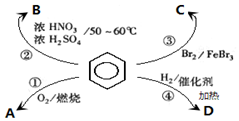

| A. | 反应①为氧化反应,反应现象是火焰明亮并带有浓烟 | |
| B. | 反应②为取代反应,有机产物B是一种芳香烃 | |
| C. | 反应③为取代反应,产物溴苯是比水重的无色液体 | |
| D. | 反应④为加成反应,若H2足量则产物D为环己烷 |
