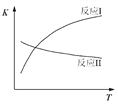
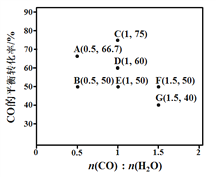
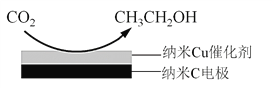
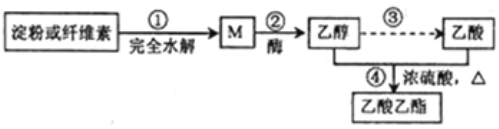
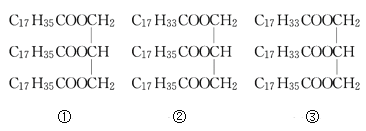题目内容
【题目】在某一容积为 2L 的恒容密闭容器中,A、B、C、D 四种气体物质发生可逆反应,其物质的量 n(mol)随时间 t(min)的变化曲线如图所示。回答下列问题:
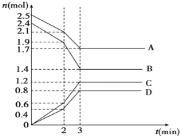
(1)该反应的化学方程式为____。
(2)前 2min 内用 A 的浓度变化表示的化学反应速率为____;
(3)在 2min 时,图象发生改变的原因可能是_____ (填字母)
A.增大 B 的物质的量 B.降低温度 C.加入催化剂 D.减小 A 的物质的量
(4)不同条件下的该反应的速率:①v(A)=1.0mol·L-1·s-1,②v(B)=1.0 m ol·L-1·s-1,③v(C)=1.2 mol·L-1·s-1,④v(D)=1.2mol·L-1·s-1。其中反应速率最快的是___ (填序号)。
【答案】4A+5B6C+4D 0.1mol/(L·min) C ④
【解析】
根据图象知,A、B物质的量减少是反应物、C和D物质的量增加是生成物,根据各物质物质的量的变化量之比等于其计量数之比,据此书写方程式,注意反应物未完全转化为生成物,此反应为可逆反应;用反应速率等于浓度的变化除以时间,求出A的反应速率;外界条件能改变反应速率,根据图形进行分析;比较反应速率的快慢根据反应速率之比等于化学计量数之比,把不同物质转化为同一物质进行比较。
(1)根据图象知,A、B物质的量减少是反应物、C和D物质的量增加是生成物,反应达到平衡时,各物质的物质的量变化量分别为:△n(A)=(2.51.7)mol=0.8mol、△n(B)=(2.41.4)mol=1.0mol、△n(C)=(1.20)mol=1.2mol、△n(D)=(0.80)mol=0.8mol,
物质的物质的量的变化量之比等于其计量数之比,所以A、B、C、 D计量数之比=0.8mol:1.0mol:1.2mol:0.8mol=4:5:6:4,反应方程式为4A+5B6C+4D;
(2)化学反应速率等于浓度的变化除以时间,前2min内用A的浓度变化表示的化学反应速率v(A)![]() ;
;
(3)在2min时,各物质的物质的量不变,故A、D不选,相同时间内物质的量变化量增大,说明加快了反应速率,降低温度反应速率减慢,B不选,只有加入催化剂能加快反应速率且瞬间各物质的物质的量不变,故答案选C;
(4) 根据反应速率之比等于化学计量数之比(4A+5B6C+4D),把不同物质转化为同一物质进行比较,如全转化为A:①v(A)=1.0mol·L-1·s-1,②v(A)=![]() ×v(B)=
×v(B)=![]() ×1.0 mol·L-1·s-1=0.8 mol·L-1·s-1,③v(A)=
×1.0 mol·L-1·s-1=0.8 mol·L-1·s-1,③v(A)=![]() ×v(C)=
×v(C)=![]() ×1.2 mol·L-1·s-1=0.8 mol·L-1·s-1,④v(A)=v(D)=1.2mol·L-1·s-1,比较数值可知其中反应速率最快的是④。
×1.2 mol·L-1·s-1=0.8 mol·L-1·s-1,④v(A)=v(D)=1.2mol·L-1·s-1,比较数值可知其中反应速率最快的是④。