题目内容
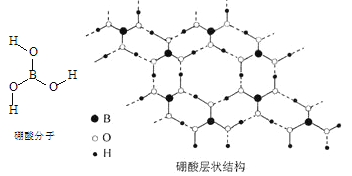
【题目】硼酸(H3BO3)是一种片层状结构的白色晶体(下图),有油腻感,可做润滑剂。硼酸对人体受伤组织有缓和和防腐作用,故可以用于医药和食品防腐等方面。回答下列问题:
(1)B原子的结构示意图为_____________________;
(2)硼酸为一元弱酸,在水中电离方程式为H3BO3+H2O![]() [B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_________________________;
[B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_________________________;
(3)下列有关硼酸晶体的说法正确的是__________;
A.H3BO3分子的稳定性与氢键有关
B.含1 molH3BO3的晶体中有3 mol氢键
C.分子中B、O最外层均为8e-稳定结构
D.B原子杂化轨道的类型sp2,同层分子间的主要作用力是范德华力
(4)根据对角线规则,与B性质相似的元素是__________。
(5)含氧酸的通式为(HO)mROn,根据非羟基氧原子数判断,与H3BO3酸性最接近的是________;
A.HClO B.H4SiO4 C.H3PO4 D.HNO2
(6)一种硼酸盐的阴离子为B3O6n-,n=_____________;B3O6n-结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O6n-的结构图(注明所带电荷数); _____________。
【答案】![]() H3BO3+OH-=B(OH)4- B Si AB 3
H3BO3+OH-=B(OH)4- B Si AB 3 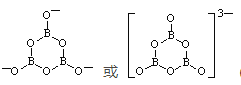
【解析】
(1)B的原子核外有5个电子,分两层排布;
(2)硼酸为一元弱酸,与氢氧根离子按照1:1反应;
(3)A.分子的稳定性与化学键有关;
B.利用均摊法计算含1molH3BO3的晶体中的氢键;
C.B原子形成3个共价键;
D.根据B原子的价层电子对判断其杂化类型;
(4)根据元素在周期表中位置判断;
(5)H3BO3的可改写为(HO)3BO0,非羟基氧原子数为0,据此分析;
(6)根据化合价的代数和等于电荷数计算;每个B原子形成3个共价键,每个O原子形成2个共价键。
(1)B的原子核外有5个电子,分两层排布,其电子排布式为: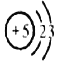 ;
;
(2)硼酸为一元弱酸,与氢氧根离子按照1:1反应,则硼酸与NaOH溶液反应的离子方程式H3BO3+OH-=B(OH)4-;
(3)A.分子的稳定性与分子内的B-O、H-O共价键有关,熔沸点与氢键有关,A错误;
B.1个硼酸分子形成了6个氢键,但每个氢键是2个硼酸分子共用的,所以平均含3个氢键,则含有1molH3BO3的晶体中有3mol氢键,B正确;
C.B原子形成3个共价键,即B原子周围有3个共用电子对,所以B周围有6个电子,不满足8电子结构,C错误;
D.B只形成了3个单键,没有孤电子对,价层电子对数为3,所以采取sp2杂化,同层分子间的主要作用力是氢键,D错误;
故合理选项是B;
(4)根据元素在周期表中位置可知,B与Si在对角线位置,所以与B性质相似的元素是Si;
(5)H3BO3可改写为(HO)3BO0,非羟基氧原子数为0,则
A.HClO可改写为(HO)ClO0,非羟基氧原子数为0;
B.H4SiO4可改写为(HO)4SiO0,非羟基氧原子数为0;
C.H3PO4可改写为(HO)3PO1,非羟基氧原子数为1;
D.HNO2可改写为(HO)NO1,非羟基氧原子数为1;
非羟基氧原子数相同,酸性相近,故AB符合题意;
(6)B3O6n-中B为+3价,O为-2价,则n=3;每个B原子形成3个共价键,每个O原子形成2个共价键,则B3O6n-的结构图为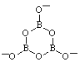 或
或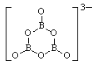 。
。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】某工业流程中,进入反应塔的混合气体中![]() 和
和![]() 物质的量百分含量分别是10%和6%,发生反应为:
物质的量百分含量分别是10%和6%,发生反应为:![]() ,在其他条件相同时,测得试验数据如下:
,在其他条件相同时,测得试验数据如下:
压强( | 温度(℃) | NO达到所列转化率所需时间(s) | ||
50% | 90% | 98% | ||
1.0 | 30 | 12 | 250 | 2830 |
90 | 25 | 510 | 5760 | |
8.0 | 30 | 0.2 | 3.9 | 36 |
90 | 0.6 | 7.9 | 74 | |
根据表中数据,下列说法正确的是
A.温度越高,越有利于NO的转化
B.增大压强,反应速率变慢
C.在![]() 、90℃条件下,当转化率为98%时反应已达平衡
、90℃条件下,当转化率为98%时反应已达平衡
D.如进入反应塔的混合气体为![]() ,如速率
,如速率![]() 表示,则在
表示,则在![]() 、30℃条件下,转化率从50%增至90%时段,NO的反应速率为
、30℃条件下,转化率从50%增至90%时段,NO的反应速率为![]()