题目内容
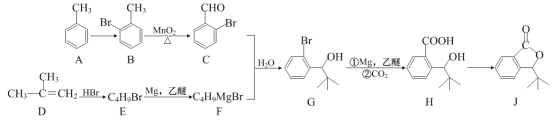
【题目】氢气是一种理想的绿色能源。利用生物发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇水蒸气重整制氢的部分反应过程如下图所示:

已知:反应I和反应II的平衡常数随温度变化曲线如图所示。
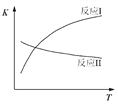
(1)反应I中,1 mol CH3CH2OH(g)参与反应后的热量变化是256 kJ。
① H2O的电子式是:_________________。
② 反应I的热化学方程式是:___________________________。
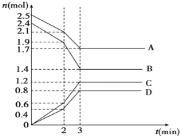
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO的平衡转化率见下图(各点对应的反应温度可能相同,也可能不同)。
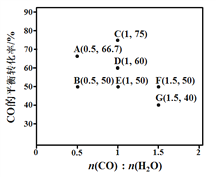
① 图中D、E两点对应的反应温度分别为TD和TE。判断:TD_______TE(填“<” “=”或“>”)。
② 经分析,A、E和G三点对应的反应温度相同,其原因是A、E和G三点对应的____相同。
③ 当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是______。
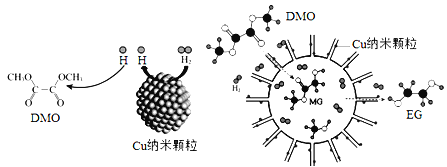
(3)反应III,在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如下图所示。
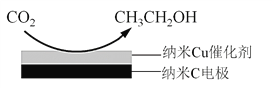
① 阴极的电极反应式是__________________________。
② 从电解后溶液中分离出乙醇的操作方法是______________。
【答案】![]() CH3CH2OH(g) + H2O(g) === 4H2(g) + 2CO(g) △H = +256 kJ·mol-1 < 化学平衡常数 进气比越大,反应温度越低 14CO2 + 12e- + 9H2O = CH3CH2OH + 12HCO3- 蒸馏
CH3CH2OH(g) + H2O(g) === 4H2(g) + 2CO(g) △H = +256 kJ·mol-1 < 化学平衡常数 进气比越大,反应温度越低 14CO2 + 12e- + 9H2O = CH3CH2OH + 12HCO3- 蒸馏
【解析】
(1)① H2O的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
② 1 mol CH3CH2OH(g)参与反应后的热量变化是256 kJ,根据图像,反应I随着温度升高,平衡常数增大,说明正反应为吸热反应,因此热化学方程式为CH3CH2OH(g) + H2O(g) === 4H2(g) + 2CO(g) △H = +256 kJ·mol-1,故答案为:CH3CH2OH(g) + H2O(g) === 4H2(g) + 2CO(g) △H = +256 kJ·mol-1;
(2)①根据图像,反应II随着温度升高,平衡常数减小,说明正反应放热反应,升温平衡逆向进行,CO转化率减小,图中D、E两点对应的反应温度分别为TD和TE.D点CO转化率大于E点CO转化率,说明TD<TE ,故答案为:<;
②E点平衡常数CO(g)+H2O(g)CO2(g)+H2(g)
起始量 1 100
变化量 0.50.50.50.5
平衡量 0.50.50.50.5
K=1
A点平衡常数CO(g)+H2O(g)CO2(g)+H2(g)
起始量 1200
变化量![]()
![]()
![]()
![]()
平衡量![]()
![]()
![]()
![]()
K=1
G点平衡常数CO(g)+H2O(g)CO2(g)+H2(g)
起始量3200
变化量1.21.21.21.2
平衡量1.80.8121.2
K=![]() =1,
=1,
A、E和G三点对应的化学平衡常数相同,因此反应温度相同,故答案为:化学平衡常数;
③ 已知CO(g)+H2O(g)CO2(g)+H2(g)△H=-42kJmol-1,反应为放热反应,升温平衡逆向进行,CO转化率减小,当不同的进气比达到相同的CO平衡转化率时,图中B、E两点E点的进气比大于B点,但转化率相同,因此需要平衡正向移动,则E点温度低于B点,即进气比越大,反应温度越低,故答案为:进气比越大,反应温度越低;
(3)① 根据图示,阴极发生还原反应,二氧化碳得到电子生成乙醇,根据题意,同时生成HCO3-,电极反应式为14CO2 + 12e- + 9H2O = CH3CH2OH + 12HCO3-,故答案为:14CO2 + 12e- + 9H2O = CH3CH2OH + 12HCO3-;
② 乙醇乙挥发,可以通过蒸馏的方法从电解后溶液中分离出乙醇,故答案为:蒸馏。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案【题目】已知下列物质在20℃下的Ksp如下,
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 | 2.0×10-48 | 2.0×10-12 |
下列说法不正确的是
A. 20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是:Ag2CrO4>AgCl>AgBr>AgI>Ag2S。
B. 向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,c(Br -) /(Cl -)=2.7×10-3
C. 测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是K2CrO4
D. 某溶液中含有Cl-、Br-和I-,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,Cl-最先沉淀出来