题目内容
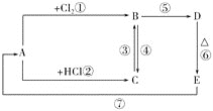
【题目】A是一种红棕色金属氧化物;B、D是金属单质;J是一种难溶于水的白色化合物,受热易分解。

回答下列问题:
(1)A、E、J、G的化学式分别为___、___、___、___。
(2)C转化为I的离子方程式为___。
(3)H和I反应生成J的离子方程式为___。
(4)如何检验E溶液中大量存在的阳离子?___。
【答案】Fe2O3 FeCl2 Al(OH)3 Fe(OH)3 Al2O3+2OH-═2AlO2-+H2O Al3++3AlO2-+6H2O═4Al(OH)3↓ 取E溶液2mL于试管中,滴入几滴KSCN溶液,无现象,再滴入几滴氯水,溶液呈血红色,则含有Fe2+
【解析】
A是一种红棕色金属氧化物,则A是Fe2O3,红褐色沉淀G为Fe(OH)3,分解可以生成氧化铁,则F是Fe(OH)2.B、D是金属单质,Fe2O3和B在高温下能反应生成金属单质D,则该反应是铝热反应,B是Al,D是Fe,C是Al2O3,J是一种不溶于水的白色化合物,受热容易分解成C,则J是Al(OH)3,由转化关系可知,I是NaAlO2,H是AlCl3;铁和盐酸反应生成氯化亚铁和氢气,E和氨水反应生成Fe(OH)2,则E是FeCl2,以此解答该题。
(1)由以上分析可知,则A为Fe2O3,E是FeCl2,J是Al(OH)3,G是Fe(OH)3;
(2)氧化铝是两性氧化物,与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O;
(3)铝离子和偏铝酸根之间双水解而不共存,反应的离子方程式为Al3++3AlO2-+6H2O═4Al(OH)3↓;
(4)E是FeCl2,检验亚铁离子,可取E溶液2mL于试管中,滴入几滴KSCN溶液,无现象,再滴入几滴氯水,溶液呈血红色,则含有Fe2+。

【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z
2Z
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 升高温度平衡常数增大,则此反应为吸热反应
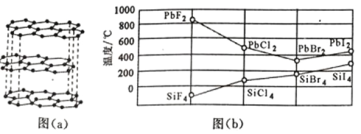
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为___。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 为:___,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:___,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)Bodensteins研究了下列反应:2HI(g)H2(g)+I2(g) ΔH=+11kJ·mol-1,
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为___。若起始时n(HI)=100mol,则过程中需吸收的能量为___kJ。
②上述反应中,正反应速率为v正=k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为___(以K和k正表示)。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为___(填字母)