题目内容
16.下列关于溶液酸碱性说法正确的是( )| A. | PH=7,溶液一定显中性 | |
| B. | 当溶液c(H+)=c(OH-)时,溶液显中性 | |
| C. | 正盐溶液一定显中性,酸性盐溶液可能显酸性或碱性 | |
| D. | 当溶液显酸性时,水电离的c(H+)>c(OH-) |
分析 溶液的酸碱性取决于溶液中c(OH-)、c(H+)的相对大小,如果c(OH-)>c(H+),溶液呈碱性,如果c(OH-)=c(H+),溶液呈中性,如果c(OH-)<c(H+),溶液呈酸性.
解答 解:A、pH=7的溶液不一定呈中性,如100℃时,纯水的pH<7,则该温度下,pH=7的溶液呈碱性,故A错误;
B、溶液中如果c(OH-)=c(H+),则溶液呈中性,故B正确;
C、正盐溶液不一定显中性,若为强碱弱酸的正盐溶液,则显碱性,若为强酸弱碱的正盐溶液,则显酸性,故C错误;
D、水电离出的c(H+)和c(OH-)永远相等,故D错误.
故选B.
点评 本题考查溶液酸碱性的判断,明确溶液的酸碱性取决于溶液中c(OH-)、c(H+)的相对大小是解本题关键,易错选项是D,注意不能单纯根据pH判断溶液的酸碱性,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.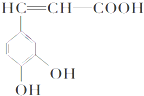 咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列 关于咖啡酸的说法不正确的是( )
咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列 关于咖啡酸的说法不正确的是( )
 咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列 关于咖啡酸的说法不正确的是( )
咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列 关于咖啡酸的说法不正确的是( )| A. | 咖啡酸的分子式为C9H8O4 | |
| B. | 1 mol咖啡酸可以和含4 molBr2的浓溴水反应 | |
| C. | 1 mol咖啡酸与足量NaHCO3溶液反应能产生标况下约67.2L的CO2 | |
| D. | 不可以用高锰酸钾检验咖啡酸分子中的碳碳双键 |
4.下列关于Cl2、Cl-的说法都正确的是( )
| A. | 有毒 | B. | 呈黄绿色 | ||
| C. | 属于同种元素 | D. | 能和金属单质反应 |
11.在氯水中存在多种分子和离子,它们在不同的反应中表观各自的性质,下列实验观象和结论一致且正确的是( )
| A. | 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 氯气长时间放置后酸性减弱 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |
1.羧基硫(COS)可作为一种食熏蒸剂,能防止某些昆虫、线虫和真菌的危害,T℃时,在体积为2L的恒容密闭容器中,将10molCO和一定量的H2S混合加热并进行下列反应;CO(g)+H2S(g)?COS(g)+H2(g) K=0.1,经过2min达到平衡,此时CO的物质的量为8mol,下列说法正确的是( )
| A. | 0~1min,CO的平均反应速率为o.5mol/(L•min) | |
| B. | 增大压强,化学反应速率加快,K增大 | |
| C. | H2S的平衡转化率为71.4% | |
| D. | 平衡后,又加入CO、H2各1mol,平衡逆动 |
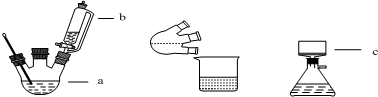
9.某化学小组采用下图装置,以环己醇制备环己烯:
已知
已知:温度高于100℃时,原料环己醇易和水形成共沸物一起被蒸出反应体系.
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①如图1导管B除了导气外还具有的作用是冷凝.
②加热试管A采用热水浴,而非直接加热.目的是控制温度85℃左右,防止环己醇挥发,使受热均匀,试管C置于冰水浴中的目的是防止环己烯挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.
加入饱和食盐水,振荡、静置、分层,环己烯在上层 层(填“上”或“下”),分液后用c(填入编号)洗涤.
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从g口进入(填字母).
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c.
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)制环己烯时,由于浓硫酸的强氧化性,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验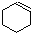 、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
④⑤①⑤②③(或④⑤①⑤③②)(填序号)①%2和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水④无水CuSO4 ⑤品红溶液.
已知

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①如图1导管B除了导气外还具有的作用是冷凝.
②加热试管A采用热水浴,而非直接加热.目的是控制温度85℃左右,防止环己醇挥发,使受热均匀,试管C置于冰水浴中的目的是防止环己烯挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.
加入饱和食盐水,振荡、静置、分层,环己烯在上层 层(填“上”或“下”),分液后用c(填入编号)洗涤.
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从g口进入(填字母).
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c.
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)制环己烯时,由于浓硫酸的强氧化性,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验
 、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
、SO2、CO2及水蒸气,混合气体通过试剂的顺序是④⑤①⑤②③(或④⑤①⑤③②)(填序号)①%2和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水④无水CuSO4 ⑤品红溶液.

 如图是实验室制取溴苯的装置,说明:
如图是实验室制取溴苯的装置,说明:
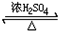 CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.