题目内容
5.在25℃时,向100ml足量的盐酸溶液里放入5.60g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2min末,收集到1.12L(标准状况下)氢气.在此之后,又经过4min,铁粉完全溶解.则:(1)在前2min内用FeCl2表示的平均反应速率是0.25mol/(L.min)
(2)在后4min内用HCl表示的平均反应速率是0.25mol/(L.min)
(3)前2min与后4min相比,反应速率较快的是前2分钟,其原因是随着反应的进行,盐酸浓度降低,反应速率减慢.
分析 发生Fe+2HCl=FeCl2 +H2 ↑,反应开始至2min末,收集到1.12L(标准状况下)氢气,n(H2)=n(FeCl2)=$\frac{1.12L}{22.4L/mol}$=0.05mol;又经过4min,铁粉完全溶解,n(HCl)=2n(Fe)=2×$\frac{5.6g}{56g/mol}$=0.2mol,结合v=$\frac{△c}{△t}$计算速率,该反应中反应速率之比等于化学计量数之比,浓度减小使反应速率减小,以此来解答.
解答 解:(1)发生Fe+2HCl=FeCl2 +H2 ↑,反应开始至2min末,收集到1.12L(标准状况下)氢气,n(H2)=n(FeCl2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,前2min内用FeCl2表示的平均反应速率是$\frac{\frac{0.05mol}{0.1L}}{2min}$=0.25 mol/(L.min),故答案为 0.25 mol/(L.min);
(2)又经过4min,铁粉完全溶解,n(HCl)=2n(Fe)=2×$\frac{5.6g}{56g/mol}$=0.2mol,后4min内减少的HCl为0.2mol-0.05mol×2=0.1mol,用HCl表示的平均反应速率是$\frac{\frac{0.1mol}{0.1L}}{4min}$=0.25 mol/(L.min),故答案为:0.25 mol/(L.min);
(3)根据同一反应、同一时间段内中,各物质的反应速率之比等于计量数之比,所以前两分钟内,氯化氢的平均反应速率为0.5mol/(L.min),而2min-4min时,氯化氢的平均反应速率为0.25 mol/(L.min),所以前两分钟内反应速率快,原因是:随着反应的进行,氢离子的浓度不断减小,所以反应速率降低,
故答案为:前2分钟;随着反应的进行,盐酸浓度降低,反应速率减慢.
点评 本题考查化学反应速率的计算及影响因素,为高频考点,把握反应速率的计算为解答的关键,注意(2)中计算为解答的易错点,题目难度不大.

| A. | 不可将水直接倒入浓硫酸中进行稀释 | |
| B. | 浓硫酸可用于干燥O2、CO2 | |
| C. | 硝酸与铁反应可产生H2 | |
| D. | 浓硫酸对皮肤或衣服有很强的腐蚀性 |
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 物质燃烧反应都是放热反应 | |
| C. | 酸碱中和反应可能是吸热反应 | |
| D. | 放热反应不要加热就能发生反应 |
| A. | 纯碱属于碱 | B. | 钢属于纯净物 | ||
| C. | 冰醋酸属于混合物 | D. | 水属于氧化物 |
| A. | 按系统命名法,化合物CH3CH(CH2CH3)2名称3-甲基戊烷 | |
| B. | 用新制的Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖 | |
| C. | 有机物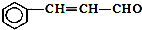 可发生加成反应、氧化反应、还原反应和聚合反应 可发生加成反应、氧化反应、还原反应和聚合反应 | |
| D. | 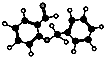 图所示的有机物分子式为C14H12O2,不能发生银镜反应 图所示的有机物分子式为C14H12O2,不能发生银镜反应 |
 某研究性学习小组根据氧化还原反应规律,欲探究NO2、NO与Na2O2反应的情况.
某研究性学习小组根据氧化还原反应规律,欲探究NO2、NO与Na2O2反应的情况.