题目内容
【题目】根据要求回答下列问题: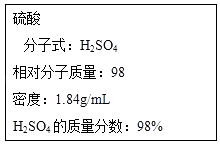
如图为实验室某浓硫酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
(1)该浓硫酸中H2SO4的物质的量浓度为
(2)某学生欲用上述浓硫酸和蒸馏水配制250mL物质的量浓度为0.4molL﹣1的稀硫酸,该学生需要量取上述浓硫酸进行配制.
(3)为配制(2)中的稀硫酸,下列可供选用的仪器中,一定用到的是(填编号),配制过程中还缺少的仪器是(填写仪器名称)
①玻璃棒;②胶头滴管;③量筒;④药匙;⑤圆底烧瓶;⑥天平;⑦烧杯;⑧普通漏斗
(4)取上述配制好的硫酸溶液50mL与足量的铝反应,所得溶液中c(Al3+)=(忽略溶液体积的变化),检验溶液中SO42﹣存在的方法: .
【答案】
(1)18.4mol/L
(2)5.4mL
(3)①②③⑦,250mL容量瓶
(4)![]() mol/L,取少量试液,向其中滴入盐酸,无现象,再加氯化钡溶液出现白色沉淀,即存在SO42﹣
mol/L,取少量试液,向其中滴入盐酸,无现象,再加氯化钡溶液出现白色沉淀,即存在SO42﹣
【解析】解:(1)浓硫酸的物质的量浓度= ![]() =
= ![]() mol/L=18.4mol/L,
mol/L=18.4mol/L,
所以答案是:18.4mol/L;
(2)浓硫酸稀释前后溶质的物质的量不变,浓硫酸体积= ![]() =5.4mL,
=5.4mL,
所以答案是:5.4mL;
(3)配制一定物质的量浓度硫酸溶液需要的仪器有:烧杯、玻璃棒、250mL容量瓶、胶头滴管、量筒,所以需要的仪器有①②③⑦,还需要250mL容量瓶,
所以答案是:①②③⑦;250mL容量瓶;
(4)硫酸和Al反应生成硫酸铝,根据SO42﹣守恒得c[Al2(SO4)3]= ![]() c(H2SO4),硫酸铝中铝离子和硫酸根离子浓度为2:3,所以c(Al3+)=2c[Al2(SO4)3]=2×
c(H2SO4),硫酸铝中铝离子和硫酸根离子浓度为2:3,所以c(Al3+)=2c[Al2(SO4)3]=2× ![]() c(H2SO4)=
c(H2SO4)= ![]() ×0.4mol/L=
×0.4mol/L= ![]() mol/L;硫酸根离子用盐酸酸化的氯化钡溶液检验,其检验方法为取少量试液,向其中滴入盐酸,无现象,再加氯化钡溶液出现白色沉淀,即存在SO42﹣,
mol/L;硫酸根离子用盐酸酸化的氯化钡溶液检验,其检验方法为取少量试液,向其中滴入盐酸,无现象,再加氯化钡溶液出现白色沉淀,即存在SO42﹣,
所以答案是: ![]() mol/L;取少量试液,向其中滴入盐酸,无现象,再加氯化钡溶液出现白色沉淀,即存在SO42﹣.
mol/L;取少量试液,向其中滴入盐酸,无现象,再加氯化钡溶液出现白色沉淀,即存在SO42﹣.
【考点精析】解答此题的关键在于理解配制一定物质的量浓度的溶液的相关知识,掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】实验室用密度为1.25gmL﹣1、质量分数为36.5%的浓盐酸配制240mL 0.1molL﹣1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为 .
(2)配制 240mL 0.1molL﹣1 的盐酸
应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次 ) .
A.用30mL水洗涤烧杯内壁和玻璃棒23次,洗涤液均注入容量瓶,振荡
B.用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线12cm处
(4)若实验中遇到下列情况,对盐酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①用于稀释盐酸的烧杯未洗涤, .
②容量瓶中原有少量蒸馏水, .
③定容时观察液面俯视, .
(5)若实验过程中出现如下情况如何处理?
①定容时加蒸馏水时超过了刻度 .
②向容量瓶中转移溶液时有滚液不慎有溶液溅出 .
③定容摇勻后发现液面下降 .
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5 , 反应PCl5(g)=PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前50 s 的平均速率v(PCl3)=0.0032 molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 molL﹣1 , 则反应的△H<0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2 , 反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0 mol Cl2 , 达到平衡时,PCl3 的转化率小于80%