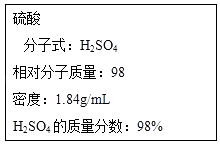
题目内容
【题目】有关药品的保存和使用不正确的是( )
A.溴水盛于带磨砂玻璃塞的细口瓶中
B.硫酸铜粉末、氯化钙等药品贮存于干燥器中
C.白磷需浸入水中密封保存
D.用碳酸钠滴定盐酸时,Na2CO3液应盛于酸式滴定管中
【答案】D
【解析】
A. 溴水是液体,有强氧化性,易挥发,应盛于带磨砂玻璃塞的细口瓶,A选项正确;
B. 硫酸铜粉末、氯化钙等药品易吸水,贮存于干燥器中可防止吸水,B选项正确;
C. 白磷易被空气中的氧气氧化,浸入水中密封保存能与空气隔绝,且白磷不与水反应、不溶于水、密度比水大,C选项正确;
D. Na2CO3溶液呈碱性,不能盛于酸式滴定管中,应盛于碱式滴定管中,D选项错误;
答案选D。

【题目】CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2 , 在催化剂的作用下发生反应:CO(g)+Cl2(g)COCl2(g)△H=a kJ/mol
反应过程中测定的部分数据如表:
t/min | n (CO)/mol | n (Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
(1)比较各时段平均速率v(COCl2):v(0﹣1)v(0﹣2);v(0﹣2)v(1﹣2) (填“>”、“=”或“<”).
(2)在2min~4min间,v(Cl2)正v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=
(3)已知X、L可分别代表温度或压强,如图表示L一定时,CO的砖化率随X的变化关系.
X代表的物理量是;a0 (填“>”,“=”,“<”),依据是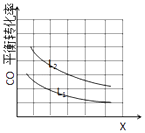
【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂.亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)2ClNO(g).
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)2ClNO(g) K3
则K1 , K2 , K3之间的关系为K3= .
(2)T℃时,2NO(g)+Cl2(g)2ClNO(g)的正反应速率表达式为v正=k cn(ClNO),测得速率和浓度的关系如表:
序号 | c(ClNO)/molL﹣1 | v/molL﹣1s﹣1 |
① | 0.30 | 3.6×10﹣8 |
② | 0.60 | 1.44×10﹣7 |
③ | 0.90 | 3.24×10﹣7 |
n=;k=(注明单位).
(3)在2L的恒容密闭容器中充入4molNO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A: 
①温度为T1时,能作为该反应达到平衡的标志的有;
a.容器体积保持不变 b.容器压强保持不变 c.平衡常数K保持不变
d.气体颜色保持不变 e.v(ClNO)=v(NO) f.NO与 ClNO的物质的量比值保持不变
②反应开始到10min时Cl2的平均反应速率v(Cl2)=;
③温度为T2时,10min已经达到平衡,该反应的平衡常数K=(注明单位).
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随 ![]() 的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的点.
的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的点.
【题目】在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(选填“吸热”、“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是;
A.容器中压强不变
B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)
D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态(是或否)处于平衡状态?若不是,反应向哪个方向进行? . (选填“向正反应方向”、“向逆反应方向”).
(4)若830℃时,向容器中充入lmolCO、5molH2O,反应达到平衡后,CO的转化率为 .