题目内容
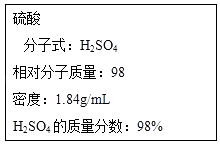
【题目】某课外小组欲鉴定某硫酸钠样品中是否含有亚硫酸钠,设计方案如下:取少量固体配成溶液,往溶液中滴加少量酸性KMnO4溶液,观察溶液是否褪色.如果溶液紫色褪去,说明该样品中含有亚硫酸钠. 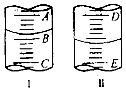
(1)用离子方程式表示该反应原理: .
(2)图I表示100mL量筒中液面的位置,A与B,B与C刻度间相差10mL,如果刻度A为30,量筒中液体的体积是mL.图II表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填字母)
A.等于amL B.等于(25﹣a)mL C.大于amL D.大于(25﹣a)mL
(3)该小组同学欲测定样品中亚硫酸钠的含量,操作步骤如下:
a.称取mg样品,用蒸馏水溶解并置于锥形瓶中
b.将V1mL C1mol/L的酸性KMnO4溶液(过量)倒入锥形瓶中振荡
c.用C2mol/L草酸钠(Na2C2O4)溶液滴定过量的KMnO4 , 至滴定终点时用去Na2C2O4溶液V2mL
①KMnO4溶液应装在式滴定管中,达到滴定终点时溶液颜色的变化 .
②样品中Na2SO3的物质的量为mol.(用含C1、V1、C2、V2的代数式表示).
(4)下列操作会导致测得的Na2SO3的物质的量偏高的是(填字母,双选).
A.未用Na2C2O4标准液润洗滴定管
B.滴定前仰视盛有Na2C2O4溶液的滴定管,滴定后俯视
C.滴定前滴定管尖嘴处有气泡,滴定后消失
D.滴定时摇动锥形瓶,瓶中的液滴溅出.
【答案】
(1)5SO32﹣+2MnO4﹣+6H+=5SO42﹣+2Mn2++3H2O
(2)22.0;D
(3)酸;紫色褪去且半分钟不恢复;10﹣3×(2.5C1V1﹣C2V2)
(4)BD
【解析】解:(1)该反应原理为酸性KMnO4溶液的强氧化性将亚硫酸钠氧化成硫酸钠,而KMnO4溶液被还原成锰离子,离子方程式为:5SO32﹣+2MnO4﹣+6H+=5SO42﹣+2Mn2++3H2O,所以答案是:5SO32﹣+2MnO4﹣+6H+=5SO42﹣+2Mn2++3H2O;(2)量筒小刻度在下,A与B,B与C刻度间相差10mL,刻度A为30,则刻度B为20,AB间每一小格为2mL,则量筒中液体的体积为22.0mL;滴定管刻度0刻度在上,从上到下增大,图Ⅱ表示25mL滴定管中液面的位置.如果液面处的读数是a,且最大刻度以下没有刻度,则滴定管中液体的体积一定大于(25﹣a) mL,
所以答案是:22.0;D;(3)①KMnO4溶液具有强氧化性,可以腐蚀橡皮管,故KMnO4溶液应装在酸式滴定管中;KMnO4溶液呈紫色,滴入最后一滴Na2C2O4溶液,紫色褪去,说明滴定到终点,所以答案是:酸;紫色褪去且半分钟不恢复;
②用C2mol/L草酸钠(Na2C2O4)溶液滴定过量的KMnO4 , 至滴定终点时用去Na2C2O4溶液V2mL,根据得失电子守恒,则剩余高锰酸钾物质的量为 ![]() mol,所以与亚硫酸钠溶液反应消耗的高锰酸钾溶液为C1V1×10﹣3mol﹣
mol,所以与亚硫酸钠溶液反应消耗的高锰酸钾溶液为C1V1×10﹣3mol﹣ ![]() mol,依据反应的离子方程式:
mol,依据反应的离子方程式:
2MnO4﹣+ | 5SO32﹣+ | 6H+ | = | 2Mn2++ | 5SO42﹣+ | 3H2O |
2 | 5 |
C1V1×10﹣3mol﹣ ![]() mol
mol ![]() ×(C1V1×10﹣3mol﹣
×(C1V1×10﹣3mol﹣ ![]() mol)=10﹣3×(2.5C1V1﹣C2V2)mol
mol)=10﹣3×(2.5C1V1﹣C2V2)mol
所以答案是:10﹣3×(2.5C1V1﹣C2V2);(4)A.未用Na2C2O4标准液润洗滴定管,则导致滴定时消耗Na2C2O4体积偏大,所以计算出剩余高锰酸钾物质的量也就偏大,则与亚硫酸根离子反应的高锰酸钾偏小,导致测得的Na2SO3的物质的量偏小,故A错误;
B.滴定前仰视盛有Na2C2O4溶液的滴定管,滴定后俯视,则导致滴定时消耗Na2C2O4体积偏小,所以计算出剩余高锰酸钾物质的量也就偏小,则与亚硫酸根离子反应的高锰酸钾偏大,导致测得的Na2SO3的物质的量偏大,故B正确;
C.滴定前滴定管尖嘴处有气泡,滴定后消失,则导致滴定时消耗Na2C2O4体积偏大,所以计算出剩余高锰酸钾物质的量也就偏大,则与亚硫酸根离子反应的高锰酸钾偏小,导致测得的Na2SO3的物质的量偏小,故C错误;
D.滴定时摇动锥形瓶,瓶中的液滴溅出,则导致滴定时消耗Na2C2O4体积偏小,所以计算出剩余高锰酸钾物质的量也就偏小,则与亚硫酸根离子反应的高锰酸钾偏大,导致测得的Na2SO3的物质的量偏大,故B正确;
故选:BD.

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2 , 在催化剂的作用下发生反应:CO(g)+Cl2(g)COCl2(g)△H=a kJ/mol
反应过程中测定的部分数据如表:
t/min | n (CO)/mol | n (Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
(1)比较各时段平均速率v(COCl2):v(0﹣1)v(0﹣2);v(0﹣2)v(1﹣2) (填“>”、“=”或“<”).
(2)在2min~4min间,v(Cl2)正v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=
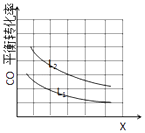
(3)已知X、L可分别代表温度或压强,如图表示L一定时,CO的砖化率随X的变化关系.
X代表的物理量是;a0 (填“>”,“=”,“<”),依据是