题目内容
4.有A、B、C、D、E 5种化合物中,其中A、B、C、D是铝元素的化合物,F是一种气体,在标准状况下对空气的相对密度是1.103,且有下列反应:①A+NaOH-→D+H2O ②B-→A+H2O ③C+NaOH (适量)-→B+NaCl ④E+H2O-→NaOH+F ⑤C+D+H2O-→B
则A、B、C、D化学式分别是:AAl2O3BAl(OH)3.CAlCl3. DNaAlO2
写出4mol C和6mol E在水溶液中发生反应的化学方程式4AlCl3+6Na2O2+6H2O═4Al(OH)3↓+3O2↑+12NaCl.
分析 由气体F在标准状况下对空气的相对密度知M (F)=29×1.103=32,故F是O2;由④的反应知E中必含有Na,且能与水反应放出O2,故E为Na2O2;由反应③可知C中一定含有Cl元素,又结合题给条件知C中还含有Al元素,故C为AlCl3,D为NaAlO2;在铝的常见的化合物中,受热分解成一种化合物和水的物质应该是氢氧化铝,故B为Al(OH)3,由此判定A一定为Al2O3,据此答题;
解答 解:由气体F在标准状况下对空气的相对密度知M (F)=29×1.103=32,故F是O2;由④的反应知E中必含有Na,且能与水反应放出O2,故E为Na2O2;由反应③可知C中一定含有Cl元素,又结合题给条件知C中还含有Al元素,故C为AlCl3,D为NaAlO2;在铝的常见的化合物中,受热分解成一种化合物和水的物质应该是氢氧化铝,故B为Al(OH)3,由此判定A一定为Al2O3,
(1)由以上分析可知A为Al2O3,B为Al(OH)3,C为AlCl3,D为NaAlO2,
故答案为:Al2O3;Al(OH)3;AlCl3;NaAlO2;
(2)4molAlCl3和6molNa2O2在水溶液中发生,6molNa2O2可生成12molNaOH,则生成氢氧化铝和氧气,方程式为4AlCl3+6Na2O2+6H2O═4Al(OH)3↓+3O2↑+12NaCl,
故答案为:4AlCl3+6Na2O2+6H2O═4Al(OH)3↓+3O2↑+12NaCl.
点评 本题考查无机物的推断,注意根据相对密度计算相对分子质量的应用,结合物质的转化关系解答该题,牢固掌握常见元素化合物的性质为解答该题的关键.题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
15.下列离子方程式的书写正确的是( )
| A. | 铁跟稀盐酸反应2Fe+6H+═2Fe3++3H2↑ | |
| B. | 盐酸中加入碳酸钙CO32-+2H+═H2O+CO2↑ | |
| C. | CO2通入足量澄清石灰水中CO2+Ca2++2OH-═CaCO3↓+H2O | |
| D. | NaHCO3溶液中加入盐酸CO32-+2H+═H2O+CO2↑ |
19.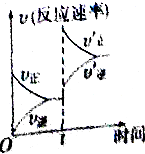 工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )
工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )
 工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )
工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )| A. | 增大压强 | B. | 降低温度 | C. | 升高温度 | D. | 分离出氨气 |
9.下列各组物质中,所含分子数一定相同的是( )
| A. | 1gH2和8gO2 | |
| B. | 0.1molHCl和2.24LHe | |
| C. | 150℃,1.01×105Pa时,18LH2O和18LCO2 | |
| D. | 常温常压下28gCO和6.02×1022个CO分子 |
16. 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验.可选择的试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水.(提示:K3[Fe(CN)6]溶液和亚铁离子结合生成蓝色沉淀).
(1)请完成下表:
【实验结论】Fe的氧化产物为Fe2+和Fe3+
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束后,试管中残留固体为黑色.
(2)装置B的作用是防倒吸.
(3)经小组讨论并验证该无色气体为O2,其验证方法是用带火星的木条深入集气瓶中,木条复燃证明无色气为氧气.
(4)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水.
【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O.
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验.
【实验评价】根据上述实验,不能确定固体产物成分的实验是b(填实验编号).
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有Ag、NO2、O2.
 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验.可选择的试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水.(提示:K3[Fe(CN)6]溶液和亚铁离子结合生成蓝色沉淀).
(1)请完成下表:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | ① | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 ②,振荡 | ③ | 存在Fe2+ |
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束后,试管中残留固体为黑色.
(2)装置B的作用是防倒吸.
(3)经小组讨论并验证该无色气体为O2,其验证方法是用带火星的木条深入集气瓶中,木条复燃证明无色气为氧气.
(4)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水.
【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O.
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验.
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有Ag、NO2、O2.
14.下列自发反应可用焓判据来解释的是( )
| A. | 2N2O5(g)═4NO2(g)+O2(g)△H=+56.7kJ•mol-1 | |
| B. | (NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1 | |
| D. | CaCO3(g)═CaO(s)+CO2(g)△H=+178.2kJ•mol-1 |
