题目内容
12.实验室用锌跟足量的稀硫酸反应制取氢气,若要制得2.24L(标准状况)氢气,需要多少摩尔锌?同时要消耗20%的硫酸(密度=1.14g/cm3)多少mL?分析 根据Zn+H2SO4=ZnSO4+H2↑计算参加反应Zn的物质的量、参加反应H2SO4的质量,结合质量分数计算硫酸溶液质量,再根V=$\frac{m}{ρ}$计算H2SO4的体积.
解答 解:设反应Zn的物质的量为x、参加反应H2SO4的质量为y,则:
Zn+H2SO4Cl=ZnSO4+H2↑
1mol 98g 22.4L
x y 2.24L
所以x=$\frac{1mol×2.24L}{22.4L}$=0.1mol
y=$\frac{98g×2.24L}{22.4L}$=9.8g
故硫酸溶液的体积为(9.8g÷20%)÷1.14g/mL≈42.98mL,
答:需要锌的物质的量为0.1mol,需要硫酸的体积约是42.98mL.
点评 本题考查化学方程式计算,侧重考查学生计算能力,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列行为符合实验安全要求的是( )
| A. | 实验室废液直接倒入水槽中 | |
| B. | 点燃可燃性气体前,必须检验气体的纯度 | |
| C. | 不慎洒出的酒精在实验台上着火时,立即用水浇灭 | |
| D. | 大量氯气泄漏时,迅速离开现场,并尽量向低凹处去 |
17. 某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池、装置如图所示.下列说法正确的是( )
某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池、装置如图所示.下列说法正确的是( )
 某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池、装置如图所示.下列说法正确的是( )
某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池、装置如图所示.下列说法正确的是( )| A. | 碳棒上发生的主要反应为:2H++2e-═H2↑ | |
| B. | 铝质易拉罐作为电池的正极 | |
| C. | 电池总反应为:4Al+3O2+6H2O═4Al(OH)3 | |
| D. | 电流流动方向为:铝质易拉罐→导线→扬声器→导线→碳棒→浸透食盐水的布 |




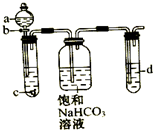 某同学为了探究元素非金属性递变规律,设计了如图所示实验装置.
某同学为了探究元素非金属性递变规律,设计了如图所示实验装置. 科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:
科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有: