题目内容
19.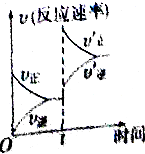 工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )
工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )| A. | 增大压强 | B. | 降低温度 | C. | 升高温度 | D. | 分离出氨气 |
分析 温度和压强能引起正逆反应速率瞬间变化,升高温度,正逆反应速率加快,化学平衡向着吸热方向进行,增大压强,正逆反应速率加快,化学平衡向着气体体积减小的方向进行,改变反应物的浓度只能引起某个方向的速率瞬间变化,据此回答判断.
解答 解:从图中看出,t时刻,正逆反应速率迅速增大,所以是加压或是升温,但是正反应速率快于逆反应速率,所以平衡正向进行,所以改变的条件是升高温度.
故选C.
点评 本题以图象题为载体,考查学生影响化学反应速率的因素和平衡移动的因素,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
9.下列离子方程式书写正确的是( )
| A. | 向漂白粉溶液中通入少量SO2:Ca2++2ClO-+2H2O+SO2═CaSO3↓+2HClO | |
| B. | 实验室用石灰石制备CO2:CO32-+2H+═CO2↑+H2O | |
| C. | 向NH4HCO3溶液中加入足量稀NaOH溶液:NH4++OH-═NH3•H2O | |
| D. | 向NaOH溶液中通入少量Cl2:Cl2+2OH-═ClO-+Cl-+H2O |
14.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | “地沟油”禁止食用,但可用作制取肥皂的原料 | |
| B. | 因为铝单质不易被氧化,所以铝制用品有一定的抗腐蚀性 | |
| C. | 氮和硫的氧化物任意排放都会造成大气的污染 | |
| D. | 石油裂化、煤的气化、煤的液化的过程中都包含化学变化 |
8.80℃时水的离子积常数KW=3.6×10-13,该温度时纯水的pH值( )
| A. | 等于7 | B. | 小于7? | C. | 大于 | D. | 无法确定 |
9.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1mol/L NaCl溶液中含有NA个Na+ | |
| B. | 18g H2O中含有NA个H2、NA个O | |
| C. | NA个CCl4分子在标准状况下的体积约为22.4L | |
| D. | 2.3gNa+中含有NA个电子 |
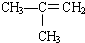 ⑥
⑥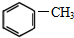 ⑤
⑤
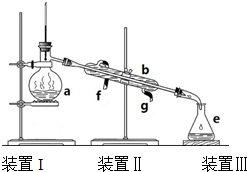
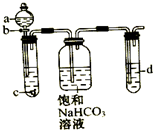 某同学为了探究元素非金属性递变规律,设计了如图所示实验装置.
某同学为了探究元素非金属性递变规律,设计了如图所示实验装置.