题目内容
下列反应的离子方程式书写正确的是
| A.氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu |
| B.稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| C.氢氧化钡溶液与稀 H2SO4反应:Ba2++SO42-=BaSO4↓ |
| D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
A
解析试题分析:离子方程式正误判断——注意“七查”。1.“一查”是否符合客观事实,2.“二查”“反应条件”“连接符号”“↑”“↓”是否使用恰当,3.“三查”拆分是否正确,4.“四查”是否“漏写”离子反应,5.“五查”是否符合三个守恒(1)质量守恒(2)电荷守恒(3)得失电子守恒,6.“六查”是否符合离子配比,7.“七查”反应物的“量”——过量、少量、足量等。A、氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu,正确;B、稀 H2SO4与铁粉反应生成硫酸亚铁和氢气,不符合客观事实,错误;C、氢氧化钡溶液与稀 H2SO4反应:Ba2++SO42-=BaSO4↓,漏掉氢离子与氢氧根生成水的反应,错误;D、碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑,碳酸钙为难溶物,应用化学式表示,错误。
考点:考查离子方程式正误判断。

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
下列各组离子在指定条件下能大量共存的是 ( )
| A.无色溶液中: Na +、Cu2+、Cl-、NO3- |
| B.强酸性溶液中:Na+、K +、OH-、SiO32 - |
| C.含Fe3+的溶液中:K+、Ca2+、NO3-、SCN- |
| D.澄清透明溶液中:Fe2+、Na+、SO42-、Cl- |
下列离子方程式书写正确的是
| A.Na2S2O3溶液中加入稀硫酸:2S2O32— + 4H+ = SO42— + 3S↓ + 2H2O |
B.用铜作电极电解CuSO4溶液:2Cu2+ + 2H2O 2Cu + O2↑+ 4H+ 2Cu + O2↑+ 4H+ |
| C.将H2O2滴加到酸性KMnO4溶液中:2MnO4—+H2O2+6H+=2Mn2+ +3O2 ↑+4H2O |
| D.向含有FeBr2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl— |
下列离子方程式与所述事实相符且正确的是
| A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B.用FeCl3溶液腐蚀铜板制印刷电路板:Fe3++2Cu=Fe2++2Cu2+ |
| C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ |
| D.碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
下列离子方程式中不正确的是( )
| A.氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+2NH4+=Mg2++2NH3·H2O |
B.铜片接电源正极,碳,棒接电源负极,电解硫酸溶液Cu+2H+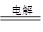 Cu2++H2↑ Cu2++H2↑ |
C.磷酸一氢钠溶液水解:HPO42—+H2O PO43-+H3O+ PO43-+H3O+ |
| D.漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀: Fe3++3ClO—+3H2O=Fe(OH)3↓+3HClO |
下列离子方程式的书写及评价均合理的是( )
| 选项 | 离子方程式 | 评价 |
| A | 将2molCl2通入到含1molFeI2的溶液中: ,2Fe2++2I—+2Cl2 = 2Fe3++4Cl-+I2, | 正确;Cl2过量,可将Fe2+ 、I—均氧化 |
| B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++ HCO3—+ OH—=" " MgCO3↓+ H2O | 正确;酸式盐与碱反应生成正盐和水 |
| C | 过量SO2通入到NaClO溶液中: SO2 + H2O + ClO- = HClO+HSO3- | 正确; 说明酸性: H2SO3强于HClO |
| D | 1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合:2AlO2- + 5H+ = Al3+ + Al(OH)3↓+ 3H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2:3 |
在下列给定条件的溶液中,一定能大量共存的离子组是
| A.澄清透明溶液:H+、Na+、SO42-、C6H5O- |
| B.常温下Kw/c(H+)=0.1 mol/L的溶液:K+、Na+、SiO32-、NO3- |
| C.铁片加入产生气泡的溶液:Na+、NH4+、I-、NO2- |
| D.NaHCO3溶液:K+、Na+、SO42-、Al3+ |
下列离子组在指定溶液中能大量共存的是( )
A.强酸溶液中: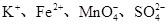 |
B.滴加石蕊试液显红色的溶液中: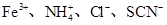 |
C.既能溶解Al(OH)3又能溶解H2SiO3的溶液中: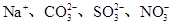 |
D.在含有大量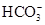 的溶液中 的溶液中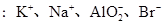 |