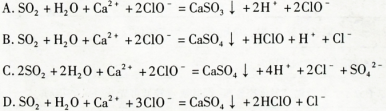题目内容
下列各组离子在指定条件下能大量共存的是 ( )
| A.无色溶液中: Na +、Cu2+、Cl-、NO3- |
| B.强酸性溶液中:Na+、K +、OH-、SiO32 - |
| C.含Fe3+的溶液中:K+、Ca2+、NO3-、SCN- |
| D.澄清透明溶液中:Fe2+、Na+、SO42-、Cl- |
D
解析试题解析:A、Cu2+为蓝色,不能存在于无色溶液中,错误;B、OH-不能大量共存于强酸性溶液中,错误;C、Fe3+与SCN-不能大量共存,错误;D、四种离子均不反应,可以大量共存,正确,答案选D。
考点:考查离子的大量共存问题

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
下列离子方程式正确的是 ( )
A.氯气和水发生反应 |
B.金属钠和水反应 |
C.用氢氧化钠除去铝表面的氧化膜时产生气泡的反应 |
D.将金属铁加人稀硫酸和硝酸钾混合溶液中,金属溶解 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.能使甲基橙变黄的溶液中:Na+、K+、SO42-、Al3+ |
| B.pH=2的溶液中:Na+、ClO-、NH4+、SO42- |
| C.某透明澄清的溶液中:NH4+、Cu2+、NO3-、Cl- |
| D.0.1 mol·L-1NaHCO3溶液中:K+、Ba2+、OH-、Cl- |
在室温下,某溶液中由水电离出的H+浓度为1.0×10-13 mol·L-1,则此溶液中一定不可能大量存在的离子组是
| A.Mg2+、NO3-、Cl-、Na+ | B.Al3+、SO42-、Cl-、K+ |
| C.Na+、Fe2+、SO42-、NO3- | D.S2-、SO32-、K+、Na+ |
下列反应的离子方程式书写正确的是
| A.氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu |
| B.稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| C.氢氧化钡溶液与稀 H2SO4反应:Ba2++SO42-=BaSO4↓ |
| D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
下列离子方程式均正确的是( )
A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+ Cu2++2Fe2+ Cu2++2Fe2+ |
B.铜与浓硝酸反应:Cu+N +2H+ +2H+ Cu2++NO2↑+H2O Cu2++NO2↑+H2O |
C.向NaAlO2溶液中通入过量CO2:2Al +CO2+3H2O +CO2+3H2O 2Al(OH)3↓+C 2Al(OH)3↓+C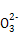 |
D.NaHCO3的水解:HC +H2O +H2O H3O++C H3O++C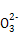 |
有一澄清透明溶液,含有H+、Fe3+、Fe2+、Al3+、AlO2—、CO32—、NO3—中的几种,向溶液中逐滴加入1 mol·L-1 NaOH溶液,开始没有沉淀生成,后产生沉淀,沉淀达到最大量后继续滴加NaOH溶液时沉淀部分消失。下列判断正确的是 ( )。
| A.一定不含Fe3+和Fe2+ |
| B.一定含有Al3+,Fe3+、Fe2+至少含有一种或两种皆有 |
| C.溶液可能含有NO3— |
| D.一定含有Fe3+,一定不含Fe2+ |
下列所述事实与化学(或离子)方程式不相符的是 ( )。
| A.能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O |
| B.能说明NH3结合H+能力比H2O强:NH3+H3O+=NH4++H2O |
| C.能说明盐酸是强酸:2HCl+CaCO3=CaCl2+CO2↑+H2O |
D.能说明CH3COOH是弱电解质:CH3COO-+H2O CH3COOH+OH- CH3COOH+OH- |