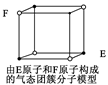
题目内容
下列说法正确的是
| A.电负性最大的原子价电子构型:3S23p5 |
| B.N3-、CO2和O3互为等电子体,所以它们空间构型都是直线型 |
| C.共价键和离子键都既有方向性又有饱和性 |
| D.根据VSEPR理论判断SF6空间构型为 正八面体 |
D
试题分析:电负性最大的原子是F,价电子构型:2S22p5 A错误
N3-、CO2和O3互为等电子体,只有CO2空间构型都是直线型,其余是V型的, B错误
根据VSEPR理论,S原子以sp3d2杂化轨道形成σ键,分子为正八面体形分子,正确。故选D。
点评:熟练掌握共价键和离子键的特点及 VSEPR理论才能准确处理各种离子,分子的空间构型。
方向性,即要按照一定的方向形成作用力。饱和性,即形成了特定数目的作用力。
离子键:阴离子与阳离子之间的作用力,离子可以看成是均匀的带电小球,所以,既没有方向性,也没有饱和性,即,只要阴离子足够大,就能在表面的各个方向尽可能多的吸引阳离子,反之,阳离子也是这样。
共价键:是原子通过电子云的重叠形成的作用,所以,既有方向性,也有饱和性,即电子云要按照一定的方向重叠,才能保证最大重叠,保证共价键的稳定性,所以导致了分子中的共价键间的键角。另外,原子都有自己特定的成键数目,如H原子只能形成1个共价键,O原子可以形成2个键,即饱和性。

练习册系列答案
相关题目
 在下列化合物中:H2O2 、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
在下列化合物中:H2O2 、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题: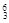 Li ②
Li ②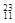 Na ③
Na ③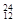 Mg ④
Mg ④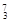 Li ⑤
Li ⑤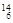 C ⑥C60 ⑦石墨,为同位素的是 ,互为同素异形体的是 。(填编号)
C ⑥C60 ⑦石墨,为同位素的是 ,互为同素异形体的是 。(填编号)
 、④
、④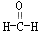 等,其中分子中C原子为SP2杂化的
等,其中分子中C原子为SP2杂化的