题目内容
(12分)(1)Cu位于元素周期表第I B族,Cu2+的核外电子排布式为 。
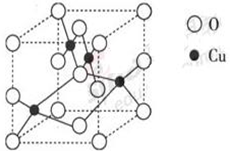
(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4 H2O,其结构示意图如下:
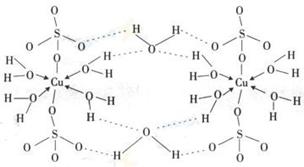
下列说法正确的是 (填字母)。
(4)Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因 。
(5)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子占有 种能量不同的原子轨道
(6)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如
①CH2=CH2、②CH≡CH、③ 、④
、④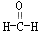 等,其中分子中C原子为SP2杂化的
等,其中分子中C原子为SP2杂化的
有 (填物质序号),预测HCHO分子的立体结构为 形。
(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。

(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4 H2O,其结构示意图如下:

下列说法正确的是 (填字母)。
| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
(5)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子占有 种能量不同的原子轨道
(6)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如
①CH2=CH2、②CH≡CH、③
 、④
、④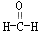 等,其中分子中C原子为SP2杂化的
等,其中分子中C原子为SP2杂化的有 (填物质序号),预测HCHO分子的立体结构为 形。
(1) 1s22s22p63s23p63d9或 [Ar]3d9 (1分) (2) 4 (2分)
(3) ABD (1分)
(4) 高 (1分), 它们都是离子晶体,由于氧离子的离子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高(2分)
(5)分子 (1分), 7 (1分)
(6)①③④ (2分),平面三角形(1分)。
(3) ABD (1分)
(4) 高 (1分), 它们都是离子晶体,由于氧离子的离子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高(2分)
(5)分子 (1分), 7 (1分)
(6)①③④ (2分),平面三角形(1分)。
试题分析:(1)Cu(电子排布式为:[Ar]3d104s1)到Cu2+的过程中,参与反应的电子是最外层的4s及3d上各一个电子,故Cu2+离子的电子排布式是为:[Ar]3d9或1s22s22p63s23p63d9;
(2)从图中可以看出阴离子在晶胞有四类:顶点(8个)、棱上(4个)、面上(2个)、体心(1个),根据立方体的分摊法,可知该晶胞中阴离子数目为:8×1/8+4×1/4+2×1/2+1=4;
(3)A项在上述结构示意图中,所有氧原子都是饱和氧原子,所以都采用sp3杂化,故A正确;B项在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,故B正确;C项胆矾是五水硫酸铜,胆矾是由水合铜离子及硫酸根离子构成的,属于离子晶体,故C错误;D项由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,结合上不同,因此受热时也会因温度不同而得到不同的产物,故D正确。
(4)由于氧离子的离子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高。
(5)易溶于CCl4、苯等有机溶剂,说明是分子晶体;基态Ni原子排布式为1s22s22p63s23p63d84s2,电子占有7种能量不同的原子轨道;
(6)SP2杂化的是平面型,有①③④,CH≡CH是直线型,是SP杂化;HCHO分子中碳是SP2,是平面型。
点评:本题考查常见元素核外电子排布、电负性概念、常见轨道杂化类型、以及离子晶体的晶胞结构、化学键、物质性质、配合物成键状况的了解,题目难度中等,学习中注意加强对晶胞以及晶体结构的分析。

练习册系列答案
相关题目

 )
)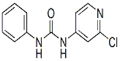
 异氰酸苯酯 2-氯-4-氨基吡啶 氯吡苯脲
异氰酸苯酯 2-氯-4-氨基吡啶 氯吡苯脲