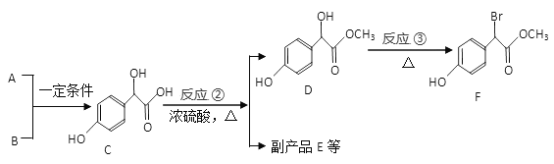
��Ŀ����
����Ŀ����֪A��B��C��D��E�Ƕ������е�5�ַǽ���Ԫ��,���ǵ�ԭ��������������AԪ��ԭ���γɵ����Ӻ��������Ϊ��,C��D��Ԫ�����ڱ��д������ڵ�λ�ã�Bԭ�ӵ��������������ڲ��������2����EԪ����DԪ��ͬ����; E�ĵ���Ϊ��ɫ���壬�����ڶ���̼��
��1����д��Ԫ�ط���:
A_______,B_______,C_________,D_________��E__________��
��2������E�������ӵĽṹʾ��ͼ:__________
��3��A�ĵ��ʺ�C�ĵ�����һ�������·�Ӧ���ɻ�����X���÷�Ӧ�Ļ�ѧ����ʽΪ_________����X��ˮ��Һ�е����̪��Һ����۲쵽_____________��
��4����9g B������������D������ȼ�գ���������ͨ��1L lmol/L NaOH��Һ�У���ȫ���պ���Һ�д������ڵ�������___________��
���𰸡� H C N O S S2-: ![]() N2+3H2
N2+3H2![]() 2NH3 ��Һ��� Na+��HCO3-��CO32-
2NH3 ��Һ��� Na+��HCO3-��CO32-
��������A��B��C��D��E�Ƕ������е�5�ַǽ���Ԫ�أ����ǵ�ԭ����������������AԪ��ԭ���γɵ����Ӻ��������Ϊ�㣬��AΪHԪ�أ�Bԭ�ӵ��������������ڲ��������2����ԭ��ֻ����2�����Ӳ㣬����������Ϊ4����BΪ̼Ԫ�أ�E�ĵ���Ϊ��ɫ���壬�����ڶ���̼����EΪSԪ�أ�EԪ����DԪ��ͬ���壬��DΪOԪ�أ�C��D��Ԫ�����ڱ��д������ڵ�λ�ã���D��ԭ����������CΪNԪ����
(1)������������֪��AΪHԪ�ء�BΪCԪ�ء�CΪNԪ�ء�DΪOԪ�أ�EΪSԪ�أ��ʴ�Ϊ��H��C��N��O��S��
(2)E��������ΪS2-�����ӽṹʾ��ͼ��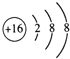 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(3)A�ĵ�����������C�ĵ����ǵ����������͵�����һ�������·�Ӧ���ɰ�����N2+3H2![]() 2NH3���ڰ�ˮ�д���NH3+H2O=NH3��H2O��NH3��H2O
2NH3���ڰ�ˮ�д���NH3+H2O=NH3��H2O��NH3��H2O ![]() NH4++OH-�����������ˮ��Һ�ʼ��ԣ������̪��Һ����Һ�ʺ�ɫ���ʴ�Ϊ��N2+3H2
NH4++OH-�����������ˮ��Һ�ʼ��ԣ������̪��Һ����Һ�ʺ�ɫ���ʴ�Ϊ��N2+3H2![]() 2NH3 ����Һ�����
2NH3 ����Һ�����
(4)9gC�����ʵ�����0.75mol��C��������������ȼ�գ�����������CO2��C+O2 ![]() CO2���������ɵĶ�����̼��0.75mol��NaOH�����ʵ���Ϊn=1L��1mol/L=1mol��������̼���������Ƶ����ʵ���֮��Ϊ3��4����CO2+NaOH=NaHCO3��CO2+2NaOH=Na2CO3+H2O��֪����������̼���������Ƶ����ʵ�����Ϊ1��1ʱ��������̼�����ƣ���������̼���������Ƶ����ʵ�����Ϊ1��2ʱ��������̼��������������̼�����������Ƶ����ʵ���֮�ȴ���
CO2���������ɵĶ�����̼��0.75mol��NaOH�����ʵ���Ϊn=1L��1mol/L=1mol��������̼���������Ƶ����ʵ���֮��Ϊ3��4����CO2+NaOH=NaHCO3��CO2+2NaOH=Na2CO3+H2O��֪����������̼���������Ƶ����ʵ�����Ϊ1��1ʱ��������̼�����ƣ���������̼���������Ƶ����ʵ�����Ϊ1��2ʱ��������̼��������������̼�����������Ƶ����ʵ���֮�ȴ���![]() С��1ʱ��������̼���ƺ�̼�����ƵĻ������ԣ���Һ�е�������̼���ƺ�̼�����ƣ��ʴ�Ϊ��CO32- HCO3-��Na+��
С��1ʱ��������̼���ƺ�̼�����ƵĻ������ԣ���Һ�е�������̼���ƺ�̼�����ƣ��ʴ�Ϊ��CO32- HCO3-��Na+��

 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�����Ŀ��ij��ѧС��ͬѧ������װ�ú��Լ�����ʵ�飬̽��O2��KI��Һ������Ӧ��������

��ѡ�Լ���30%H2O2��Һ��0.lmol/LH2SO4��Һ��MnO2���塢KMnO4����
��1��С��ͬѧ��Ƽס��ҡ�������ʵ�飬��¼����
���� | ���� | |
�� | ��I����ƿ�м���_____����I��_________�м���30%H2O2��Һ������I��. �������� | I�в�����ɫ���岢�����������������������ð������ҺѸ�ٱ��� |
�� | �����м���KMnO4���壬��������������ȼ�ƾ��� | ����������ð������Һ������ |
�� | �����м���KMnO4���壬���м�������0.1 mol/L H2SO4��Һ����������������ȼ�ƾ��� | ����������ð������Һ���� |
��2����ʵ����O2��KI��Һ��Ӧ�����ӷ���ʽ��___________________________��
��3���Ա��ҡ���ʵ���֪��O2��KI��Һ������Ӧ������������__________________��Ϊ��һ��̽���������Է�Ӧ���ʵ�Ӱ�죬�ɲ�ȡ��ʵ���ʩ��___________________________��
��4���ɼס��ҡ�����ʵ���Ʋ⣬��ʵ�������I�еİ���ʹ��Һ������ѧ����I�в���������ֱ��ͨ������__________ ������ĸ����Һ��֤���˰����к���H2O2��
A.���� KMnO4 B. FeC12 C. Na2S D.Ʒ��
��5��������ʾ��KI��Һ�ڿ����о��ù����лᱻ����������4KI+O2+2H2O==2I2+4KOH����С��ͬѧȡ20 mL���õ�KI��Һ�������м��뼸�ε�����Һ�����û�й۲쵽��Һ��ɫ���������Dz�������Ƿ����˷�Ӧ��3I2+6OH-==5I-+IO3-+3H2O��ɵġ������ʵ��֤�����ǵIJ����Ƿ���ȷ��________________________________��
����Ŀ����ͼ��ʾ�������£��ס��������ݻ���ȵ���ƿ�зֱ�װ�����������壨ͬ�¡�ͬѹ���ɷݼ��±�����ֹˮ��K��ʹ����ƿ�������ֽӴ���������ѹǿ��С�����˳����ȷ����
��� | �� | �� | �� |
�������� | H2 | NH3 | NO |
�������� | Cl2 | HCl | O2 |
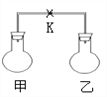
A. �ڢۢ� B. �ۢ٢� C. �ۢڢ� D. �٢ڢ�