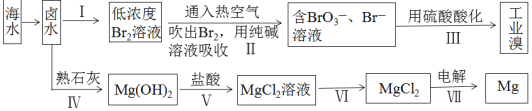
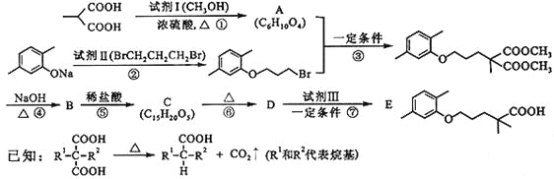
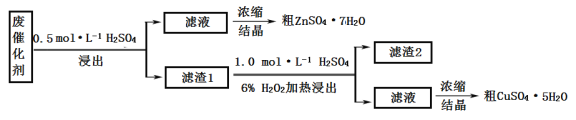
题目内容
【题目】(1)氧元素与氟元素能形成OF2分子,该分子的空间构型为__________。
(2)与![]() 等电子体的分子 ,根据等电子体原理在
等电子体的分子 ,根据等电子体原理在![]() 中氮原子轨道杂化类型是__________;
中氮原子轨道杂化类型是__________;![]() 与N2是等电子体,1 mol
与N2是等电子体,1 mol![]() 中含有的π键数目为__________个。
中含有的π键数目为__________个。
(3)下列物质的分子与O3分子的结构最相似的是__________。
A.H2O B.CO2 C.SO2 D.BeCl2
(4)O3分子是否为极性分子?__________。(填“是”或“否”)
【答案】
(1)V形
(2)CO2或CS2;sp;2NA
(3)C
(4)是
【解析】
试题分析:(1)由价层电子对互斥理论可知,OF2分子的空间构型为V形。
故答案为: V形;
(2)价电子数和原子数分别都相等的是等电子体,则与NO2+离子互为等电子体的是CO2或CS2;CO2
是含有双键的直线形结构,所以根据等电子原理,在NO2+离子中氮原子轨道杂化类型是sp杂化;与O22+离子互为等电子体的是氮气.氮气含有三键,而三键是由1个σ键和2个π键构成的,则1 mol O22+中含有的π键数目为2NA。
故答案为:CO2或CS2;sp; 2NA;
(3)根据SO2与O3互为等电子体可知SO2与O3分子的结构最相似。
故答案为:C;
(4)根据价层电子对互斥理论分析SO2分子为V形,是极性分子,SO2分子与O3分子的结构最相似,
故也是极性分子。
故答案为:是。

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
相关题目