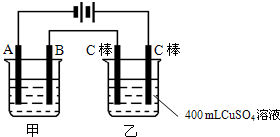
题目内容
如图为为串联的甲、乙两电解池,试回答:(1)若甲池利用电解原理在铁上镀银,则A是______极,B的电极材料是______,电极反应式为______,应选用的电解质溶液是______.
(2)若甲电解池阴极增重4.32g,则乙电解池中阳极上放出的气体在标准状况下的体积是______mL.
(3)若乙池中剩余溶液仍为400mL,则电解后产物的物质的量浓度为______mol?L-1,溶液的pH为______.
【答案】分析:根据电源的正负极可判断A、B、Fe、C分别为电解池的阴极、阳极、阴极、阳极,在阴极上发生还原反应,在阳极上发生氧化反应,乙池反应中阴极:2H2O+2e-═H2↑+20H-,阳极:2Cl--2e-═Cl2↑,若甲为用电解原理给铁片镀银的装置,阴极反应为:Ag++e-=Ag,阳极反应为:Ag-e-=Ag+,电解质溶液应选与镀层具有相同金属离子的可溶性盐溶液;
根据电极反应以及两个串联电解池转移电子数目相等计算.
解答:解:(1)根据电源的正负极可判断A、B、Fe、C分别为电解池的阴极、阳极、阴极、阳极,在阴极上发生还原反应,在阳极上发生氧化反应,在铁片上镀银时,镀层金属银为电解池的阳极,阳极上的电极反应式为Ag-e-=Ag+,镀件金属铁为电解池的阴极,阴极上的电极反应式Ag++e-=Ag,电解质溶液含有镀层金属离子,应为可溶性硝酸银溶液.
故答案为:铁;银;Ag-e-=Ag+;AgNO3溶液.
(2)甲槽阴极反应为Ag++e-=Ag,阴极增重4.32g,应为银的质量,n=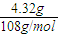 =0.04 mol,
=0.04 mol,
转移的电子为0.04mol,两个电解池串联,转移的电子数目相等,乙槽阳极反应为2Cl--2e-═Cl2↑,转移的电子为0.04mol时,在阳极上生成气体的物质的量为0.02mol,放出气体在标准状况下的体积为0.02mol×22.4L/mol=0.448L=448mL.
故答案为:448;
(3)乙池的电池反应式为2NaCl+2H2O=Cl2↑+H2↑+2NaOH,所以新生成的溶质为氢氧化钠,设氢氧化钠的物质的量为x,则
2NaCl+2H2O=Cl2↑+2NaOH+H2↑ 转移电子
2mol 2mol
x 0.04mol
所以x=0.04mol
氢氧化钠的物质的量浓度C= =0.1mol/L,C(H+ )=
=0.1mol/L,C(H+ )=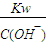 =
= mol/L=1×10-13mol/L
mol/L=1×10-13mol/L
故答案为:0.1mol?L-1;13.
点评:本题考查了电镀原理及氧化还原反应的有关计算,难度不大,抓住串联电解池得失电子数相等是解题的关键.
根据电极反应以及两个串联电解池转移电子数目相等计算.
解答:解:(1)根据电源的正负极可判断A、B、Fe、C分别为电解池的阴极、阳极、阴极、阳极,在阴极上发生还原反应,在阳极上发生氧化反应,在铁片上镀银时,镀层金属银为电解池的阳极,阳极上的电极反应式为Ag-e-=Ag+,镀件金属铁为电解池的阴极,阴极上的电极反应式Ag++e-=Ag,电解质溶液含有镀层金属离子,应为可溶性硝酸银溶液.
故答案为:铁;银;Ag-e-=Ag+;AgNO3溶液.
(2)甲槽阴极反应为Ag++e-=Ag,阴极增重4.32g,应为银的质量,n=
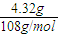 =0.04 mol,
=0.04 mol,转移的电子为0.04mol,两个电解池串联,转移的电子数目相等,乙槽阳极反应为2Cl--2e-═Cl2↑,转移的电子为0.04mol时,在阳极上生成气体的物质的量为0.02mol,放出气体在标准状况下的体积为0.02mol×22.4L/mol=0.448L=448mL.
故答案为:448;
(3)乙池的电池反应式为2NaCl+2H2O=Cl2↑+H2↑+2NaOH,所以新生成的溶质为氢氧化钠,设氢氧化钠的物质的量为x,则
2NaCl+2H2O=Cl2↑+2NaOH+H2↑ 转移电子
2mol 2mol
x 0.04mol
所以x=0.04mol
氢氧化钠的物质的量浓度C=
 =0.1mol/L,C(H+ )=
=0.1mol/L,C(H+ )=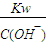 =
= mol/L=1×10-13mol/L
mol/L=1×10-13mol/L故答案为:0.1mol?L-1;13.
点评:本题考查了电镀原理及氧化还原反应的有关计算,难度不大,抓住串联电解池得失电子数相等是解题的关键.

练习册系列答案
相关题目
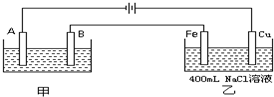
 如图为为串联的甲、乙两电解池,试回答:
如图为为串联的甲、乙两电解池,试回答: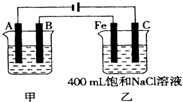 如图为相互串联的甲、乙两电解池.试回答:
如图为相互串联的甲、乙两电解池.试回答: