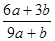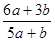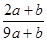题目内容
下列说法正确的是
| A.含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子 |
B.500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中充分反应生成NH3(g),放热7.72kJ,其热化学方程式为:N2(g) + 3H2(g)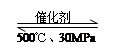 2NH3(g)△H=-38.6kJ·mol-1 2NH3(g)△H=-38.6kJ·mol-1 |
C.对于可逆反应N2(g)+3H2(g)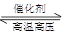 2NH3(g)△H﹤0,升高温度,可使反应速率增大,反应逆向移动 2NH3(g)△H﹤0,升高温度,可使反应速率增大,反应逆向移动 |
| D.元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
C
试题分析:A、反应开始后浓盐酸逐渐变为稀盐酸,后者不能被MnO2氧化,则消耗的n(HCl)<4mol,故转移电子数小于2NA,错误;B、可逆反应不能进行到底,则消耗的n(N2)<0.2mol,故热化学方程式的△H<-38.6kJ·mol-1,错误;C、合成氨是放热反应,升高温度时,v(正)、v(逆)均增大,平衡向逆反应方向移动,正确;D、元素原子的最外层电子数的多少与其非金属性的强弱有关,同周期主族元素从左到右,非金属性随最外层电子数增多而增强,错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目