��Ŀ����
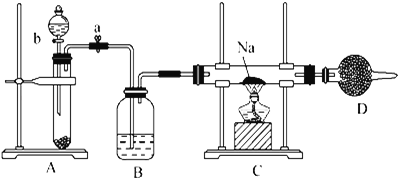
����Ŀ����1����ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ��й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺
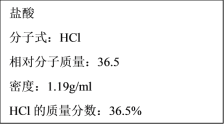
�ٸ�Ũ��������ʵ���Ũ��Ϊ___mol��L-1��
��ijѧ����������Ũ���������ˮ����480ml���ʵ���Ũ��Ϊ0.4mol��L-1��ϡ���ᣬ��ѧ��������Ͳ��ȡ___mL����Ũ����������ƣ������õ���������Ͳ���ձ�����ͷ�ιܺͲ�����֮�⣬����Ҫ___��
��2��KClO3��Ũ������һ���¶��·�Ӧ�����ɻ���ɫ���ױ����ʶ������ȣ���仯�ɱ���Ϊ��KClO3+HCl��Ũ���DKCl+ClO2��+Cl2��+
������ɸû�ѧ����ʽ������ƽ���������ѧ����ʽд�ڴ���ϣ�___��
��Ũ�����ڷ�Ӧ����ʾ������������__����д��ţ���
A.ֻ�л�ԭ�� B.��ԭ�Ժ����� C.ֻ�������� D.�����Ժ�����
��������²�����2.24LCl2��������ClO2������Ϊ__g��
����KClO3+6HCl(Ũ)=KCl+3Cl2��+3H2O�У�������²�����6.72LCl2����ת�Ƶĵ�����ĿΪ___��
���𰸡�11.9 16.8 500mL����ƿ 2KClO3+4HCl��Ũ��=2KCl+2ClO2��+Cl2��+2H2O B 13.5 0.5NA������3.01��1023��
��������
��1����c=![]() =
=![]() =11.9mol/L��
=11.9mol/L��
������480ml���ʵ���Ũ��Ϊ0.4mol��L-1��ϡ���ᣬӦѡ��500mL������ƿ������c1��V1= c2��V2��0.4mol��L-1��0.5L=11.9mol/L��V����V=16.8mL������ʵ�鲽�裬��Ҫ��������500mL����ƿ���ձ�����Ͳ������������ͷ�ιܣ�
��2���ٸ��ݼ�̬��ֻ��£���ཻ����ԭ��+5�۵�Cl��Ϊ+4�ۣ�-1�۵�Cl��Ϊ0�ۣ����õ�ʧ�����غ㣻
��Ũ�����ڷ�Ӧ��Cl�Ļ��ϼ����ߣ����ֻ�ԭ�ԣ�������ط�Ӧ�����κ�ˮ����������ԣ�
�۸���n(ClO2):n(Cl2)=2:1��m=nM���м��㣻
��KClO3�е�Cl�Ļ��ϼ���+5��Ϊ0�ۣ���5�����ӣ�����3��Cl2��
��1����c=![]() =
=![]() =11.9mol/L��
=11.9mol/L��
������480ml���ʵ���Ũ��Ϊ0.4mol��L-1��ϡ���ᣬӦѡ��500mL������ƿ������c1��V1= c2��V2��0.4mol��L-1��0.5L=11.9mol/L��V����V=16.8mL������ʵ�鲽�裬��Ҫ��������500mL����ƿ���ձ�����Ͳ������������ͷ�ιܣ�
��2���ٸ��ݼ�̬��ֻ��£���ཻ����ԭ��+5�۵�Cl��Ϊ+4�ۣ�-1�۵�Cl��Ϊ0�ۣ����õ�ʧ�����غ㣬��ʽΪ2KClO3+4HCl��Ũ��=2KCl+2ClO2��+Cl2��+2H2O��
��Ũ�����ڷ�Ӧ��Cl�Ļ��ϼ����ߣ����ֻ�ԭ�ԣ�������ط�Ӧ�����κ�ˮ����������ԣ���ΪB��
��n(ClO2):n(Cl2)=2:1������²�����2.24LCl2����0.1mol������������ClO2�����ʵ���Ϊ0.2mol����m=nM=0.2��67.5=13.5g��
��KClO3+6HCl(Ũ)=KCl+3Cl2��+3H2O�У�KClO3�е�Cl�Ļ��ϼ���+5��Ϊ0�ۣ���5�����ӣ�����3��Cl2��������²�����6.72LCl2����0.3molʱ��ת��0.5mol���ӣ���0.5NA��

 ��ڽ��ȫ������ϵ�д�
��ڽ��ȫ������ϵ�д�