题目内容
【题目】工业废水中常含有酚类、重金属、氰类、三氯甲烷及砷类等有害物质,必须处理后才可排放。
(1)用FeS除去废水中重金属汞盐的反应为Hg2++FeS![]() HgS + Fe2+,该反应的平衡常数为K=____________ [填数值,已知:Ksp(FeS)=6.4×10-15,Ksp(HgS)=1.6×10-52]。
HgS + Fe2+,该反应的平衡常数为K=____________ [填数值,已知:Ksp(FeS)=6.4×10-15,Ksp(HgS)=1.6×10-52]。
(2)处理含CN-废水有惰性电极电解法、NaClO氧化法等。
已知:HCN的Ka=6.3×10-10,沸点为25.7℃,有剧毒。
①电解前需将废水的pH调至10~11,其目的是___________。
②惰性电极电解时,CN-在阳极最终氧化为CO32-、CO2和N2。则1mol CN-在阳极被完全氧化,同时在阴极上产生H2的物质的量为___________(不考虑副反应)。
③电解后期需在废水中加入食盐继续电解,加食盐除可提高电流效率外,还因为___________。
(3)纳米零价铁除去酸性废水中的三氯乙烯、五价砷的原理如下图所示:

纳米零价铁中Fe为负极, C2HCl3在其表面被还原的电极反应式为___________;在含高浓度SO42-的酸性溶液中脱除砷的化学方程式为___________。
【答案】 4×1037 防止生成HCN,污染空气并造成人员中毒 2.5mol 阳极上生成的Cl2及溶液中产生的ClO-可氧化CN- C2HCl3+5H++8e-=C2H6 + 3Cl- 14Fe2++SO42-+AsO3-+14H+ = FeAsS↓+13Fe3++7H2O
【解析】(1)用FeS除去废水中汞盐的反应为Hg2++FeS![]() HgS + Fe2+,该反应的平衡常数为K=
HgS + Fe2+,该反应的平衡常数为K=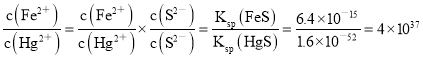 ;(2)①HCN的Ka=6.3×10-10,沸点为25.7℃,有剧毒,电解前需将废水的pH调至10~11,其目的是防止生成HCN,污染空气并造成人员中毒;②惰性电极电解时,CN-在阳极最终氧化为CO32-、CO2和N2。电极反应:4OH--4e-=2H2O+O2↑,4CN-+5O2=2CO32-+2CO2↑+2N2 ↑,1mol CN-在阳极被完全氧化,需要5/4molO2,电子转移为5mol,电子守恒,阴极电极反应为2H++2e-=H2↑,在阴极上产生H2的物质的量2.5mol。③电解后期需在废水中加入食盐继续电解,加食盐除可提高电流效率外,阳极生成的氯气和溶液中生成次氯酸盐可以氧化CN-离子;(3)纳米零价铁中Fe为负极,由图可知C2HCl3在其表面被还原为乙烷,据电荷守恒、原子守恒,电极反应为:C2HCl3+5H++8e-=C2H6+3Cl-,据图可判断亚铁离子还原AsO3-,因此在酸性溶液中脱除砷,反应的离子方程式为:14Fe2++SO42-+AsO3-+14H+ = FeAsS↓+13Fe3++7H2O。
;(2)①HCN的Ka=6.3×10-10,沸点为25.7℃,有剧毒,电解前需将废水的pH调至10~11,其目的是防止生成HCN,污染空气并造成人员中毒;②惰性电极电解时,CN-在阳极最终氧化为CO32-、CO2和N2。电极反应:4OH--4e-=2H2O+O2↑,4CN-+5O2=2CO32-+2CO2↑+2N2 ↑,1mol CN-在阳极被完全氧化,需要5/4molO2,电子转移为5mol,电子守恒,阴极电极反应为2H++2e-=H2↑,在阴极上产生H2的物质的量2.5mol。③电解后期需在废水中加入食盐继续电解,加食盐除可提高电流效率外,阳极生成的氯气和溶液中生成次氯酸盐可以氧化CN-离子;(3)纳米零价铁中Fe为负极,由图可知C2HCl3在其表面被还原为乙烷,据电荷守恒、原子守恒,电极反应为:C2HCl3+5H++8e-=C2H6+3Cl-,据图可判断亚铁离子还原AsO3-,因此在酸性溶液中脱除砷,反应的离子方程式为:14Fe2++SO42-+AsO3-+14H+ = FeAsS↓+13Fe3++7H2O。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案