题目内容
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液最好的方法是_______(写出具体实验操作,结论)。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:__________________________________。
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是_____;
②溶液组成的测定:取50.0mL待测溶液,加入足量的AgNO3溶液,得到21.525g白色沉淀。则溶液中c(Cl-)=______mol/L。
③验证该溶液中是否含有Fe2+,正确的实验方法是_____________。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液先滴入氯水再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
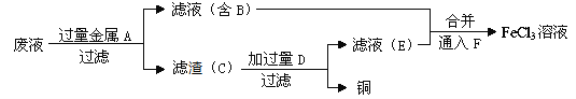
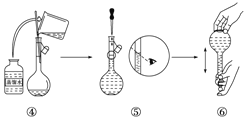
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
①滤渣C的化学式为_________________。
②加过量D发生反应的离子方程为_____________________________________。
③通入F发生反应的离子方程式为 ____________________________________ 。
【答案】用一束光照射,出现光亮通路的是Fe(OH)3胶体,不出现光亮通路的是FeCl3溶液 Cu+2Fe3+ =Cu2++2Fe2+ Fe3+ 3 B Fe、Cu Fe+2H+=Fe2++H2 Cl2+2Fe2+ =2Cl-+2Fe3+
【解析】
(1)鉴别溶液和胶体的最简单的方法是丁达尔现象,胶体具有丁达尔现象,而溶液不具有;
(2)利用Fe3+的强氧化性,结合电子守恒、原子守恒书写;
(3)①根据FeCl3溶液与铜反应:2Fe3++Cu═2Fe2++Cu2+;滴入KSCN溶液呈红色分析;
②先计算氯化银的物质的量是0.15mol,利用Cl元素守恒,确定氯离子物质的量为0.15mol,
③检验的Fe2+方法可根据其还原性及反应产生的铁离子遇KSCN溶液变为红色;
(4)根据制取的目标产物是氯化铁,金可知A是铁;滤液B是氯化亚铁溶液;加入的铁过量,滤渣C是铁和铜;制取的是氯化铁,溶解铁,D加入应该是盐酸,E为氯化亚铁,氯化亚铁与氯气反应生成氯化铁,所以F为氯气,据此回答①②③。
(1)因FeCl3溶液是溶液,无丁达尔现象,而Fe(OH)3胶体是胶体,有丁达尔现象,所以鉴别FeCl3溶液和Fe(OH)3胶体中最简单有效的是观察是否产生了丁达尔现象(效应);
(2)铜与氯化铁反应生成氯化铜、氯化亚铁,反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+;
(3)①测定FeCl3腐蚀铜后所得溶液的组成,由于滴入KSCN溶液呈红色,证明溶液中一定有Fe3+,溶液中还含有腐蚀Cu后生成的Cu2+、Fe2+,所以含有的金属离子是Fe3+、Cu2+、Fe2+;
②取50.0mL待测溶液,加入足量的AgNO3溶液,得21.525g白色沉淀,n(AgCl)=![]() mol,根据Cl元素守恒,可知n(Cl-)= 0.15mol,则溶液中c(Cl-)=
mol,根据Cl元素守恒,可知n(Cl-)= 0.15mol,则溶液中c(Cl-)=![]() ;
;
③A.观察溶液是否呈浅绿色,当溶液浓度较小时,溶液几乎无色,所以不能证明,A错误;
B.Fe2+具有还原性,能被酸性KMnO4溶液氧化,所以向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+;B正确;
C.试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,只能证明反应后溶液中含有Fe3+,不能证明原溶液是否含有Fe2+;应该先加入硫氰化钾溶液,若溶液不变色,证明无Fe3+,再加入氯水,若溶液显示红色,证明此时溶液中含有Fe3+,是Cl2氧化Fe2+而产生的Fe3+,说明原溶液含有Fe2+,C错误;
故合理选项是B;
(4)目标产物是氯化铁溶液,则金属A是铁;滤液B是氯化亚铁溶液;由于加入的铁过量,所以滤渣C是铁和铜;制取的物质是氯化铁,则溶解铁加入D物质应该是盐酸,E为氯化亚铁,氯化亚铁与氯气反应生成氯化铁,所以F为氯气。
①滤渣C的化学式为Fe、Cu;
②加过量盐酸发生反应的离子方程式为Fe+2H+=Fe2++H2↑;
③是将Fe2+氧化成Fe3+,反应方程式是:2FeCl2+Cl2=2FeCl3。

【题目】硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:

回答下列问题:
(l)Na2B4O7·10H2O中B的化合价为__________。
(2)Na2B4O7易溶于水,也易发生水解:B4O72-+7H2O![]() 4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________。
(4)加入MgO的目的是___________________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) 溶解度(g) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取NaBH4,NaBH4被称为有机化学中的“万能还原剂”。
①写出NaBH4的电子式:___________。
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为_________(保留两位小数)。
③在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式:________。