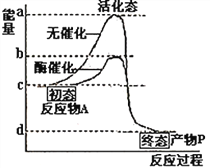
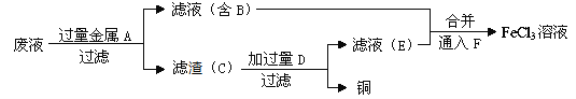
题目内容
【题目】金属及其化合物的种类很多,我们可以按照“金属单质、金属氧化物、金属氢氧化物、盐”的类别进行研究。以下是元素周期表中前18号某种金属元素对应的单质及其化合物之间的转化关系(“→”所指的转化都是一步完成)。
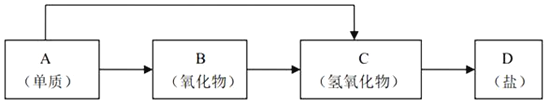
(1)若B为呼吸面具中的供氧剂,其供氧时每生成1molO2,反应过程中转移的电子数为___________________,A与水反应的离子方程式为:_____________________。
(2)200℃时,11.6g CO2和H2O的混合物气体与足量的B反应,反应后固体增加了3.6g,则原混合物的平均相对分子质量为______________。
(3)写出一种“C→D”转化的离子方程式:___________________________________。
(4)某同学将一小块A单质露置于空气中,观察到下列现象:
银白色![]() 变灰暗
变灰暗![]() 变白色
变白色![]() 出现液滴
出现液滴![]() 白色固体
白色固体
则下列说法正确的是_____________________。
A.①发生了氧化还原反应
B.①变灰暗色是因为生成了过氧化钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
【答案】2NA 2Na+2H2O=2Na++2OH﹣+H2↑ 23.2 OH﹣+H+=H2O A
【解析】
金属单质可以形成氧化物,也可以直接生成碱,金属氢氧化物一步形成盐,解题关键在金属单质可以直接形成碱的推断。A为活泼金属K、Ca、Na等;结合常见物质及各步反应转化关系分析判断。
(1)若B为呼吸面具中的供养剂,则B是Na2O2,金属A为钠,钠与水反应生成氢氧化钠和氢气;Na2O2与水反应生成O2,过氧化钠既作氧化剂,又作还原剂,根据反应原理计算电子转移数目;
(2)根据Na2O2与水、CO2反应时的物质的量关系,用差量法先计算氧气的物质的量,再计算混合气体的物质的量,根据![]() ,计算平均摩尔质量,最后求得平均相对分子质量;
,计算平均摩尔质量,最后求得平均相对分子质量;
(3)C→D转化的反应为氢氧化钠和盐酸反应生成氯化钠和水;
(4)小块金属钠露置于空气中发生的变化中,由银白色先变灰暗,再变白色,后出现液滴,最后变为白色固体,①是钠被氧化为氧化钠;发生的反应是氧化还原反应,②是氧化钠和水反应生成氢氧化钠;③氢氧化钠潮解形成氢氧化钠溶液;④是二氧化碳和氢氧化钠反应生成碳酸钠固体。
金属单质可以形成氧化物,也可以直接一步生成碱,根据氧化物B可作为供氧剂,可确定A为活泼金属Na,B是Na2O2,C是NaOH,D是NaCl等钠盐。
(1)A为钠,若B为呼吸面具中的供氧剂,则B在供氧时主要反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2↑,其供氧时每生成1mol O2,反应过程中转移的电子数为2NA,
Na与水反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;
(2)由反应:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,可知参加反应的CO2和H2O与生成O2的物质的量之比都是为2:1,m(增重)=m(吸收)-m(放出),即11.6g-m(O2)=3.6g,m(O2)=11.6g-3.6g=8.0g,所以n(O2)=![]() ,则n(CO2)+n(H2O)=0.5mol,则原混合气体的平均摩尔质量
,则n(CO2)+n(H2O)=0.5mol,则原混合气体的平均摩尔质量![]() ,所以原混合气体的平均式量是23.2;
,所以原混合气体的平均式量是23.2;
(3)C→D转化的化学方程式为:NaOH+HCl=NaCl+H2O,离子方程式为:OH-+H+=H2O;
(4)Na性质活泼,易与空气中氧气反应生成Na2O,Na2O易与水反应生成NaOH,NaOH吸收空气中的水和CO2生成Na2CO3xH2O,Na2CO3xH2O风化脱水生成Na2CO3。
A.①是Na发生氧化还原反应,生成了氧化钠, A正确;
B.②变暗色主要是因为Na和O2反应生成了氧化钠,B错误;
C.③是氢氧化钠潮解,吸收水蒸气形成氢氧化钠溶液, C错误;
D.④是二氧化碳和氢氧化钠反应生成碳酸钠溶液和水,水分蒸发,最后得到碳酸钠固体,发生了化学反应,D错误;
故合理选项是A。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe] 有关物质性质
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇, 两性化合物 | 易溶于水和乙醇,有强酸性 和还原性 | 易溶于水, 难溶于乙醇 |
实验过程:Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:将配制好的绿矾溶液与200mL 1.1mol·L-1NH4HCO3溶液混合,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。回答下列问题:

(1)实验I中:实验室配制绿矾溶液,将铁粉与稀硫酸混合时哪种试剂应该过量_______
(2)实验II中:制备FeCO3时应向_______溶液中缓慢加入________溶液边加边搅拌,若颠倒试剂滴加顺序可能产生的后果是__________________生成沉淀的离子方程式为________________
(3)确认C中空气排尽的实验现象是______________
(4)加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是___________
(5)洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是___________________。(填序号)
A.热水 B.乙醇溶液 C.柠檬酸溶液
(6)若产品的质量为17.34g,则产率为________%。