题目内容
18.下列气态氢化物最不稳定的是( )| A. | CH4 | B. | SiH4 | C. | PH3 | D. | H2S |
分析 元素的非金属性越强,对应的氢化物的稳定性越强,同周期从左到右非金属性依次增强,同主族从上到下非金属性依次减弱,据此分析.
解答 解:Si、P、S、位于同周期,同周期从左到右非金属性依次增强,则非金属性:Si<P<S,C和Si位于同主族,同主族从上到下非金属性依次减弱,则非金属性为C>Si,元素的非金属性越弱,对应的氢化物的稳定性越弱,几种元素中Si的非金属性最弱,则最不稳定的为SiH4,
故选B.
点评 本题考查非金属性的比较,题目难度不大,本题注意非金属性的比较方法和非金属性与元素对应氢化物的关系.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
9.下列各组给定原子序数的元素,不能形成原子数之比为1:1稳定共价化合物的是( )
| A. | 3和17 | B. | 1和8 | C. | 6和8 | D. | 1和6 |
6.下表是元素周期表的一部分,请回答有关问题:
(1)写出元素符号:B:C;E:Ne;F:Na.
(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与F最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)最高价氧化物的水化物碱性最强的物质的电子式 .用电子式表示F元素与J元素形成化合物的过程
.用电子式表示F元素与J元素形成化合物的过程
(4)A分别与D、J、K形成的化合物中,最稳定的HF(填化学式).
(5)在B、C、F、G、H中,原子半径最大的是Na(填元素符号).
 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | |||
| 4 | K |
(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与F最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)最高价氧化物的水化物碱性最强的物质的电子式
 .用电子式表示F元素与J元素形成化合物的过程
.用电子式表示F元素与J元素形成化合物的过程
(4)A分别与D、J、K形成的化合物中,最稳定的HF(填化学式).
(5)在B、C、F、G、H中,原子半径最大的是Na(填元素符号).
3.下列有机物属于芳香烃的是( )
| A. | 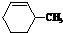 | B. | 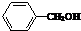 | C. |  | D. | 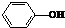 |
1.NaCl晶体的结构中,与每个钠离子距离最近且相等距离的Cl-所围成的空间构型为( )
| A. | 简单立方 | B. | 正四面体 | C. | 正八面体 | D. | 三角锥形 |



