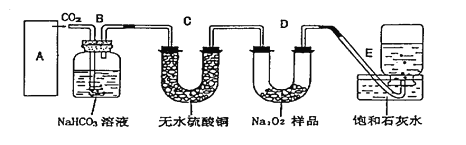
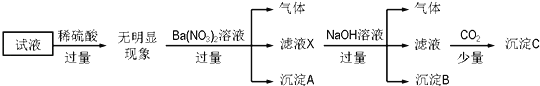
题目内容
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)钙元素的焰色反应呈砖红色,其中红色对应的辐射波长为_____(填字母)nm。
A.435 B500 C.580 D.605 E. 700
(2)元素S和Ca中,第一电离能较大的是_____(填元素符号),其基态原子核外电子排布式为_______。
(3)X射线衍射测定等发现,石膏(CaSO4 2H2O)中存在SO42-离子。SO42-离子的几何构型为_____,中心原子的杂化形式为________。
(4) 基态Ca原子中,核外电子占据最高能层的符号是____,占据该能层电子的电子云轮廓图形状为_____。钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金展锰低,原因是_________________。
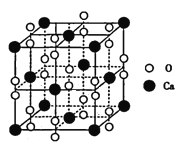
(5)过氧化钙晶体的晶胞结构如图所示,已知该晶胞的密度是ρ g cm-3,则晶胞结构中最近的两个Ca2+间的距离为______ (列算式即可,用NA表示阿伏加德罗常数的数值)nm,与Ca2+紧邻O22-的个数为______。
【答案】 E S 2s22s22p43s23p4或{ [Ne] 3s23p4} 正四面体 sp3 N 球形 Ca原子半径较大且价电子数较少,金属键较弱 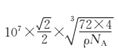 6
6
【解析】(1)钙元素的焰色反应呈砖红色,其中红色对应的辐射波长为700nm,故选E;
(2) 同周期从左至右,第一电离能逐渐增大;同族元素:从上至下第一电离能逐渐减小。元素S和Ca中,第一电离能较大的是S,S原子的基态原子核外电子排布式为2s22s22p43s23p4,故答案为:S;2s22s22p43s23p4;
(3) SO42-中S原子价层电子对=4+![]() (6+2-4×2)=4,且不含孤电子对,采用sp3杂化,所以是正四面体形结构,故答案为:正四面体;sp3;
(6+2-4×2)=4,且不含孤电子对,采用sp3杂化,所以是正四面体形结构,故答案为:正四面体;sp3;
(4) 基态Ca原子中,核外电子占据最高能层是第4层,能层符号是N,占据该能层的电子为4s电子,电子云轮廓图形状为球形。钙元素和锰元素属于同一周期,且核外最外层电子构型相同,Ca原子半径较大且价电子数较少,金属键较弱,导致金属钙的熔点、沸点等都比金属锰低,故答案为:N;球形;Ca原子半径较大且价电子数较少,金属键较弱;
(5)根据过氧化钙晶体的晶胞结构,晶胞中含有Ca2+的数目为8×![]() +6×
+6×![]() =4,含有O22-的数目为12×
=4,含有O22-的数目为12×![]() +1=4,设晶胞的边长为x,则晶胞的密度是ρ g cm-3=
+1=4,设晶胞的边长为x,则晶胞的密度是ρ g cm-3=![]() ,解得x=
,解得x=![]() cm=
cm=![]() ×107 nm,因此晶胞结构中最近的两个Ca2+间的距离为面对角线的一半=
×107 nm,因此晶胞结构中最近的两个Ca2+间的距离为面对角线的一半=![]() ×
×![]() ×107 nm,与Ca2+紧邻O22-的个数为6个,故答案为:
×107 nm,与Ca2+紧邻O22-的个数为6个,故答案为:![]() ×
×![]() ×107 ;6。
×107 ;6。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案