题目内容
【题目】NaBH4( 硼氢化钠)广泛用于贮氢、有机合成及纳米材料制取等。回答下列问题:
(1)NaBH4的电子式为_________。
(2) NaBH4水解生成H2同时生成NaBO2,每生成1mol H2 转移电子数为______个;Kreevoy 等提出在碱性溶液中该水解反应的半衰期t1/2(反应物浓度减少一半所需时间) 与温度的关系式为l gt1/2=pH-(0.034T-1.92),其他条件相同时,贮氢时为减慢水解速率,应控制pH 及T的条件是______;已知0℃、pH=10时半衰期为4.32×102min,若此时NaBH4的依度为4.32 molL.1,则t0至半衰期生成H2的平均速率为_________molL-1min-1。
(3)直接NaBH4碱性燃料电池的结构如下图所示:
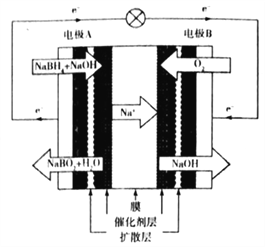
电池工作时,电极B周围溶液的pH______ (填“升高”“降低”或“不变”),电极A 上发生的电极反应式为_________________。
(4)制取NaBH4的方法之一是将Na2B4O7、SiO2 及金属Na按一定比例混合通H2 并加热到360- 370 ℃(同时生成Na2SiO3),该反应的化学方程式为______________。
【答案】 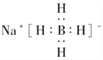 NA或6.02×1023 升高pH并降温 2×10-2 升高 BH4-+8OH--8e-=BO2-+6H2O Na2B4O3+16Na+8H2+7SiO2
NA或6.02×1023 升高pH并降温 2×10-2 升高 BH4-+8OH--8e-=BO2-+6H2O Na2B4O3+16Na+8H2+7SiO2![]() 4NaBH4+7Na2SiO3
4NaBH4+7Na2SiO3
【解析】试题分析:(1)NaBH4是离子化合物;(2) NaBH4水解生成H2同时生成NaBO2,NaBH4中氢元素化合价由-1变为0;水中氢元素由+1变为0;根据表达式lgt1/2=pH-(0.034T-1.92),PH越大反应速率减慢,温度越高反应速率加快;根据![]() 计算; (3)根据电子移动方向可知,A是负极,BH4-失电子发生氧化反应生成BO2-;B是正极氧气得电子发生还原反应生成氢氧根离子;(4)根据题意Na2B4O7、SiO2、Na、H2
计算; (3)根据电子移动方向可知,A是负极,BH4-失电子发生氧化反应生成BO2-;B是正极氧气得电子发生还原反应生成氢氧根离子;(4)根据题意Na2B4O7、SiO2、Na、H2
加热生成NaBH4、Na2SiO3。
解析:(1)NaBH4是离子化合物,电子式是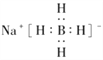 ;(2) NaBH4水解生成H2同时生成NaBO2,NaBH4中氢元素化合价由-1变为0;水中氢元素由+1变为0,所以生成1mol氢气转移电子1mol,电子数是6.02×1023;根据表达式lgt1/2=pH-(0.034T-1.92),PH越大反应速率减慢,温度越高反应速率加快,所以为减慢水解速率应升高pH并降温;NaBH4+2H2O= 4H2+NaBO2,
;(2) NaBH4水解生成H2同时生成NaBO2,NaBH4中氢元素化合价由-1变为0;水中氢元素由+1变为0,所以生成1mol氢气转移电子1mol,电子数是6.02×1023;根据表达式lgt1/2=pH-(0.034T-1.92),PH越大反应速率减慢,温度越高反应速率加快,所以为减慢水解速率应升高pH并降温;NaBH4+2H2O= 4H2+NaBO2, ![]() molL-1min-1; (3)根据电子移动方向可知,A是负极,BH4-失电子发生氧化反应生成BO2-,电极反应为BH4-+8OH--8e-=BO2-+6H2O;B是正极,氧气得电子发生还原反应生成氢氧根离子,电极反应是
molL-1min-1; (3)根据电子移动方向可知,A是负极,BH4-失电子发生氧化反应生成BO2-,电极反应为BH4-+8OH--8e-=BO2-+6H2O;B是正极,氧气得电子发生还原反应生成氢氧根离子,电极反应是![]() ,所以电极B周围溶液的pH升高;(4)根据题意Na2B4O7、SiO2、Na、H2加热生成NaBH4、Na2SiO3,反应方程式是Na2B4O3+16Na+8H2+7SiO2
,所以电极B周围溶液的pH升高;(4)根据题意Na2B4O7、SiO2、Na、H2加热生成NaBH4、Na2SiO3,反应方程式是Na2B4O3+16Na+8H2+7SiO2![]() 4NaBH4+7Na2SiO3。
4NaBH4+7Na2SiO3。

 阅读快车系列答案
阅读快车系列答案