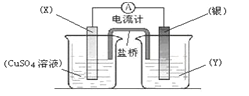
��Ŀ����
����Ŀ��2SO2��g��+O2��g��2SO3��g����H=��198kJmol��1��Ӧ���̵������仯��ͼ��ʾ����ش��������⣺ 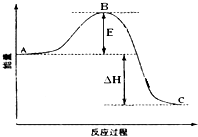
��1��ͼ��A��C�ֱ��ʾ�� �� E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ������Ӱ�죿 �� �÷�Ӧͨ���ô������Ӵ������ʹͼ��B�������ǽ��ͣ� �� ��������
��2����֪�������ȼ����Ϊ296KJmol��1 �� д����S��s������SO3��g�����Ȼ�ѧ����ʽ��
���𰸡�
��1����Ӧ�������������������������ޣ����ͣ������ܽ��ͷ�Ӧ�Ļ��
��2��S��s��+ ![]() O2��g���TSO3��g����H=��395kJ?mol��1
O2��g���TSO3��g����H=��395kJ?mol��1
���������⣺��1����ͼ��A��C�ֱ��ʾ��Ӧ������������������������BΪ��ܣ���Ӧ�ȿɱ�ʾΪA��C��ܵĴ�С֮���ܵĴ�С�뷴Ӧ���أ��������ͷ�Ӧ�Ļ�ܼӿ췴Ӧ�����ʣ������ܸı䷴Ӧ�ȣ�
���Դ��ǣ���Ӧ���������� ���������������ޣ����ͣ������ܽ��ͷ�Ӧ�Ļ�ܣ���2���������ȼ����Ϊ296kJmol��1 �� ��S��s��+O2��g��=SO2��g����H=��296kJmol��1 ��
�� 1mol SO2��g������Ϊ1mol SO3�ġ�H=��99kJmol��1 �� ��SO2��g��+ ![]() O2��g��=SO3��g����H=��99kJmol��1 ��
O2��g��=SO3��g����H=��99kJmol��1 ��
�ɸ�˹���ɿɵã�S��s��+ ![]() O2��g��=SO3��g����H=��296kJmol��1+����99kJmol��1��=��395kJmol��1 ��
O2��g��=SO3��g����H=��296kJmol��1+����99kJmol��1��=��395kJmol��1 ��
���Դ��ǣ�S��s��+ ![]() O2��g���TSO3��g����H=��395kJmol��1 ��
O2��g���TSO3��g����H=��395kJmol��1 ��
�����㾫����������Ŀ����֪���������÷�Ӧ�Ⱥ��ʱ�����֪ʶ���Եõ�����Ĵ𰸣���Ҫ�����ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�