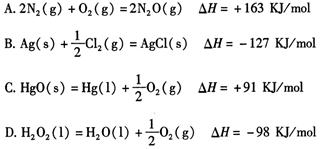题目内容
已知可逆反应CO(g)+H2O(g)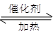 CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
| A.增大压强 | B.升高温度 | C.增大CO的浓度 | D.分离出CO2 |
D
解析试题分析:A.由于反应前后气体的物质的量不变,所以改变压强,化学平衡不移动,CO的转化率不变。错误。B. 升高温度化学平衡向吸热反应方向移动,对该反应来说,升高温度,化学平衡向逆反应方向移动,这时CO的转化率降低。错误。C. 增大CO的浓度,平衡正向移动,但平衡移动只能减弱这种改变,改变不了这种趋势,换句话说就是增大CO的浓度,增加的浓度远远大于平衡移动减小的浓度。CO的转化率反而降低。错误。D.CO2是生成物,分离出CO2也就是减小生成物的浓度,减小生成物的浓度平衡向正反应方向移动,可以使更多的CO发生反应,所以CO的转化率提高。正确。
考点:考查外界条件对化学平衡的影响及提高反应物转化率的措施。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案在一定温度下,固定体积为2L密闭容器中,发生反应:2SO2(g)+O2(g)  2SO3(g) △H<0,n(SO2)随时间的变化如表:
2SO3(g) △H<0,n(SO2)随时间的变化如表:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 3 |
| n(SO2)/mol | 0.20 | 0.1 6 | 0.13 | 0.11 | 0.08 | 0.08 |
则下列说法正确的是
A.当v(SO2)=v(SO3)时,说明该反应已达到平衡状态
B.用O2表示0~4min内该反应的平均速率为0.005mol/(L·min)
C.若升高温度,则SO2的反应速率会变大,平衡常数K值会增大
D.平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大
向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g) 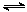 xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
| 容器 | 甲 | 乙 |
| 容积(L) | 0.5 | 0.5 |
| 反应放热(kJ) | Q1 | Q2 |
| 反应物起始量 | 1 molA 1 molB | 0.5 molA 0.5 molB |
下列说法正确的是
A.x=1
B.Q1>2Q2
C.根据题中信息无法计算a值
D.保持其他条件不变,起始时向乙容器充入0.2 mol A、0.2 mol B、0.2 mol C,则此时v(正)> v(逆)
下列反应达到化学平衡后,加压或升温都能使化学平衡向逆反应方向移动的是
A.SO2(g)+NO2(g)  SO3(g)+NO(g) ΔH<0 SO3(g)+NO(g) ΔH<0 |
B.C(s)+CO2(g)  2CO(g)ΔH>0 2CO(g)ΔH>0 |
C.4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH<0 4NO(g)+6H2O(g)ΔH<0 |
D.H2S(g)  H2(g)+S(s)ΔH>0 H2(g)+S(s)ΔH>0 |
反应Fe(s)+CO2(g) FeO(s)+CO(g),700 ℃时平衡常数为1. 47,900 ℃时平衡常数为2.15。下列说法正确的是( )
FeO(s)+CO(g),700 ℃时平衡常数为1. 47,900 ℃时平衡常数为2.15。下列说法正确的是( )
| A.升高温度该反应的正反应速率增大,逆反应速率减小 |
B.该反应的化学平衡常数表达式为K= |
| C.绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 |
| D.该反应的正反应是放热反应 |
在一个不导热的密闭反应器中,只发生两个反应:a(g)+b(g) 2c(g) △H1<0,x(g)+3y(g)
2c(g) △H1<0,x(g)+3y(g) 2z(g) △H2<0。进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是
2z(g) △H2<0。进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是
| A.等压时,通入惰性气体,c的物质的量不变 |
| B.等压时,通入z气体,反应器中温度下降 |
| C.等容时,通入惰性气体,各反应速率不变 |
| D.等容时,通入z气体,z的物质的量浓度增大 |
一定条件下,向密闭容器中加入X物质发生反应:3X(g)  Y(g) + Z(g) △H<0,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是
Y(g) + Z(g) △H<0,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是
| 反应时间(min) | 0 | 5 | 15 | 17 | 20 |
| X的浓度(mol·L-1) | 1.0 | 0.4 | 0.4 | 0.7 | 0.7 |
B.5 min时反应达到平衡,该温度下的平衡常数值为0.625
C.15 min时改变的条件可能是降低温度
D.从初始到18 min时,X的转化率为30 %
已知反应4NH3+5O2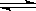 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是( )
A.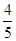 v(NH3)=v(O2) v(NH3)=v(O2) | B.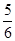 v(O2)=v(H2O) v(O2)=v(H2O) | C.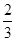 v(NH3)=v(H2O) v(NH3)=v(H2O) | D.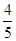 v(O2)=v(NO) v(O2)=v(NO) |