题目内容
反应Fe(s)+CO2(g) FeO(s)+CO(g),700 ℃时平衡常数为1. 47,900 ℃时平衡常数为2.15。下列说法正确的是( )
FeO(s)+CO(g),700 ℃时平衡常数为1. 47,900 ℃时平衡常数为2.15。下列说法正确的是( )
| A.升高温度该反应的正反应速率增大,逆反应速率减小 |
B.该反应的化学平衡常数表达式为K= |
| C.绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 |
| D.该反应的正反应是放热反应 |
C
解析试题分析:A.升高温度无论是放热反应还是吸热反应反应速率都增加。故该反应的正反应速率增大,逆反应速率也增加。错误。B.固体的浓度在反应的过程中不变。该反应的化学平衡常数表达式为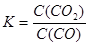 。错误。C. 绝热容器中进行该反应,如果反应未达到平衡,无论是放出热量还是吸收热量,都会使体系的温度发生变化。如果温度不再变化,则达到化学平衡状态。正确。D.由于升高温度化学平衡常数增加。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,对该反应来说,升高温度平衡向正反应方向移动。正反应方向是吸热反应方向。故该反应的正反应是吸热反应。错误。
。错误。C. 绝热容器中进行该反应,如果反应未达到平衡,无论是放出热量还是吸收热量,都会使体系的温度发生变化。如果温度不再变化,则达到化学平衡状态。正确。D.由于升高温度化学平衡常数增加。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,对该反应来说,升高温度平衡向正反应方向移动。正反应方向是吸热反应方向。故该反应的正反应是吸热反应。错误。
考点:考查平衡常数的表达式及外界条件对化学反应速率和化学平衡的影响的知识。

一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)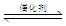 2CO2(g)+S(l) △H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l) △H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
| A.平衡前,随着反应的进行,容器内压强始终不变 |
| B.平衡时,其他条件不变,分离出硫,正反应速率加快 |
| C.平衡时,其他条件不变,升高温度可提高SO2的转化率 |
| D.其他条件不变,使用不同催化剂,该反应的平衡常数不变 |
已知可逆反应CO(g)+H2O(g)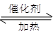 CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
| A.增大压强 | B.升高温度 | C.增大CO的浓度 | D.分离出CO2 |
四个体积相同的密闭容器中在一定的条件下发生反应: 2SO2+O2  2SO3,反应开始时,反应速率由大到小排列顺序正确的是
2SO3,反应开始时,反应速率由大到小排列顺序正确的是
| 容器 | 温度 | SO2(mol) | O2(mol) | 催化剂 |
| 甲 | 500℃ | 10 | 5 | - |
| 乙 | 500℃ | 10 | 5 | V2O5 |
| 丙 | 450℃ | 8 | 5 | - |
| 丁 | 500℃ | 8 | 5 | - |
A.乙>甲>丁>丙 B.乙>甲>丙>丁 C.甲>乙=丁>丙 D.乙>甲>丙=丁
下列说法正确的是
| A.氨水加水稀释后,溶液中c(NH3·H2O) /c(NH4+)的值减小 |
| B.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
| C.常温下,2NO(g)+O2(g)=2NO2(g)能够自发进行,则该反应的△H<0 |
| D.相同条件下,Na2CO3溶液的碱性强于C6H5ONa,说明C6H5OH的酸性强于H2CO3 |
把6molA和5molB两气体通入容积为4L的密闭容器中,一定条件下反应:3A(g)+ B(g)  2C(g)+xD(g)DH<0 ;5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1.下列说法中正确的是
2C(g)+xD(g)DH<0 ;5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1.下列说法中正确的是
| A.B的转化率为25% |
| B.A的平均反应速率为0.15mol·(L·min)-1 |
| C.恒温下达到平衡的标志是C和D的生成速率相等 |
| D.降低温度,逆反应速率变小,正反应速率增大,平衡正向移动 |
一定条件下,对于可逆反应X(g)+3Y(g)  2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.12 mol/L,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.12 mol/L,则下列判断正确的是( )
| A.c1 : c2=1 : 3 |
| B.平衡时,3VY (正) =2VZ (逆) |
| C.X、Y的转化率相等 |
| D.c1的取值范围为0.06<c1<0.16 mol/L |
在密闭容器中,放入镍粉并充入一定量CO气体,一定条件下发生反应:Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
| A.上述生成Ni(CO)4(g)的反应为吸热反应 |
| B.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 |
| C.在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol/L,则此时v正<v逆 |
| D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大 |
 CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法中正确的是( )
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法中正确的是( )