题目内容
下列反应在任何温度下均能自发进行的是: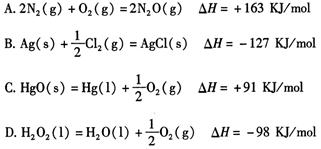
D
解析试题分析:当反应的△H<0、△S>0时能自发进行。
考点:化学反应自发进行的条件。

 小学教材全测系列答案
小学教材全测系列答案在一定条件下,向一体积为2 L的恒容密闭容器中充入2 mol A,1 mol B,发生反应:2A(g)+B 3C(g) ΔH=-Q kJ/mol(Q>0)。经过60 s达到平衡,测得B的物质的量为0.2 mol,下列对该平衡的叙述正确的是( )
3C(g) ΔH=-Q kJ/mol(Q>0)。经过60 s达到平衡,测得B的物质的量为0.2 mol,下列对该平衡的叙述正确的是( )
| A.用C的浓度变化表示该反应速率为2.4 mol/(L·min) |
| B.若使容器变为1 L,则C的物质的量一定增大 |
| C.达到平衡,测得放出热量为x kJ,则x=Q |
| D.若向容器中再充入1 mol C,重新达到平衡,A的体积分数保持不变,则B为气态 |
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g) 2CO2(g)+S(l) △H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l) △H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
| A.平衡前,随着反应的进行,容器内压强始终不变 |
| B.平衡时,其他条件不变,分离出硫,正反应速率加快 |
| C.平衡时,其他条件不变,升高温度可提高SO2的转化率 |
| D.其他条件不变,使用不同催化剂,该反应的平衡常数不变 |
取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g) N2O4(g) ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
N2O4(g) ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是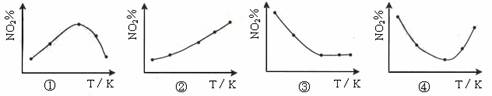
| A.②④ | B.② | C.①② | D.③④ |
已知可逆反应CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
| A.增大压强 | B.升高温度 | C.增大CO的浓度 | D.分离出CO2 |
四个体积相同的密闭容器中在一定的条件下发生反应: 2SO2+O2  2SO3,反应开始时,反应速率由大到小排列顺序正确的是
2SO3,反应开始时,反应速率由大到小排列顺序正确的是
| 容器 | 温度 | SO2(mol) | O2(mol) | 催化剂 |
| 甲 | 500℃ | 10 | 5 | - |
| 乙 | 500℃ | 10 | 5 | V2O5 |
| 丙 | 450℃ | 8 | 5 | - |
| 丁 | 500℃ | 8 | 5 | - |
A.乙>甲>丁>丙 B.乙>甲>丙>丁 C.甲>乙=丁>丙 D.乙>甲>丙=丁
把6molA和5molB两气体通入容积为4L的密闭容器中,一定条件下反应:3A(g)+ B(g)  2C(g)+xD(g)DH<0 ;5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1.下列说法中正确的是
2C(g)+xD(g)DH<0 ;5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1.下列说法中正确的是
| A.B的转化率为25% |
| B.A的平均反应速率为0.15mol·(L·min)-1 |
| C.恒温下达到平衡的标志是C和D的生成速率相等 |
| D.降低温度,逆反应速率变小,正反应速率增大,平衡正向移动 |
恒温恒容密闭容器中,进行反应A(s)+2B(g) C(g)+D(g),下列能作为化学平衡状态标志的是:①混合气体的密度;②容器内气体的压强;③混合气体总物质的量;④B的物质的量浓度
C(g)+D(g),下列能作为化学平衡状态标志的是:①混合气体的密度;②容器内气体的压强;③混合气体总物质的量;④B的物质的量浓度
| A.①④ | B.②③ | C.②③④ | D.只有④ |
下列反应中符合下图图像的是( )
A.N2(g)+3H2(g) 2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0) 2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0) |
B.2SO3(g) 2SO2(g)+O2(g) ΔH=+Q2 kJ·mol-1(Q2>0) 2SO2(g)+O2(g) ΔH=+Q2 kJ·mol-1(Q2>0) |
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-Q3 kJ·mol-1(Q3>0) 4NO(g)+6H2O(g) ΔH=-Q3 kJ·mol-1(Q3>0) |
D.H2(g)+CO(g) C(s)+H2O(g) ΔH=+Q4 kJ·mol-1(Q4>0) C(s)+H2O(g) ΔH=+Q4 kJ·mol-1(Q4>0) |