题目内容
 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ?mol -1
②CH3OH(g)+
| 1 |
| 2 |
下列说法正确的是( )
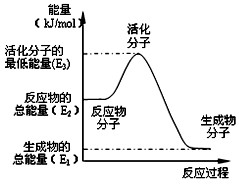
| A、反应②中的能量变化如图所示,则△H2=E1-E3 |
| B、CH3OH的燃烧热△H=-192.9 kJ?mol -1 |
| C、H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收能量 |
| D、根据②推知:在25℃,101 kPa时,1mol CH3OH(g)燃烧生成CO2和H2O(l)放出的热量应大于192.9 kJ |
B、甲醇燃烧热是1mol甲醇完全燃烧生成二氧化碳和液态水放出的热量;
C、依据反应①②可知甲醇转化为氢气可以吸热,也可以放热;
D、氢气燃烧放热分析判断;
B、依据甲醇燃烧热是1mol甲醇完全燃烧生成二氧化碳和液态水时放出的热量,数值大于192.9KJ,CH3OH的燃烧热△H<-192.9 kJ?mol -1 ,故B错误;
C、依据反应①②可知甲醇转化为氢气可以吸热,也可以放热,故C错误;
D、氢气燃烧放热,根据②推知:在25℃,101 kPa时,1mol CH3OH(g)燃烧生成CO2和H2O(l)放出的热量应大于192.9 kJ,故D正确;
故选D.

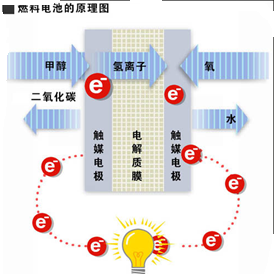 直接甲醇燃料电池(DMFC),它属于质子交换膜燃料电池(PEMFC)中之一类,系直接使用水溶液以及蒸汽甲醇为燃料供给能源,而不需通过重组器高温重组甲醇、汽油及天然气等再取出氢以供发电.下列对于该电池的说法不正确的是( )
直接甲醇燃料电池(DMFC),它属于质子交换膜燃料电池(PEMFC)中之一类,系直接使用水溶液以及蒸汽甲醇为燃料供给能源,而不需通过重组器高温重组甲醇、汽油及天然气等再取出氢以供发电.下列对于该电池的说法不正确的是( )| A、直接甲醇燃料电池低温生电、燃料成分危险性低与电池结构简单等特性 | B、电池工作时,电解质溶液pH值保持不变 | C、电池的负极反应式为3O2+12e-+12H+?6H2O | D、电池工作时,1molCH3OH被氧化时就有6NA个氢离子在正极消耗 |
(12分)车载甲醇质子交换膜燃料电池(PEMFC)将甲醇蒸气转化为氢气的工 艺有两种:(1)水蒸气变换(重整)法;(2)空气氧化法。两种工艺都得 到副产品CO。
1.分别写出这两种工艺的化学方程式,通过计算,说明这两种工艺的优缺点。有关资料(298 .15K)列于表3。
表3 物质的热力学数据
物质 | ΔfHm | Sm |
CH3OH(g) | -200.66 | 239.81 |
CO2(g) | -393.51 | 213.64 |
CO(g) | -110.52 | 197.91 |
H2O(g) | -241.82 | 188.83 |
H2 (g) | 0 | 130.59 |
2.上述两种工艺产生的少量CO会吸附在燃料电池的Pt或其他贵金属催化剂表面,阻碍H2的吸附和电氧化,引起燃料电池放电性能急剧下降,为此,开发了除去CO的方法。现有一组实验结果(500K)如表4。

表中PCO、PO2 分别为CO和O2的分压;rco为以每秒每个催化剂Ru活性位上所消耗的CO分子数表示的CO的氧化速率。(1)求催化剂Ru上CO氧化反应分别对CO和O2的反应级数(取整数),写出 速率方程。(2)固体Ru表面具有吸附气体分子的能力,但是气体分子只有碰到空活性位才可能发生吸附作用。当已吸附分子的热运动的动能足以克服固体引力场的势垒时,才能脱附,重新回到气相。假设CO和O2的吸附与脱附互不影响,并且表面是均匀的,以θ表示气体分子覆盖活性位的百分数(覆盖度),则气体的吸附速率与气体的压力成正比,也与固体表面的空活性位数成正比。研究提出CO在Ru上的氧化反应的一种机理如下:
 其中kco,ads、 kco,des分别为CO在Ru的活性位上的吸附速率常数和脱附速率常数,ko2,ads为O2在Ru的活性位上的吸附速率常数。M表示Ru催化剂表面上的活性位。CO在Ru表面活性位上的吸附比O2的吸附强得多。试根据上述反应机理推导CO在催化剂Ru表面上氧化反应的速率方程(不考虑O2的脱附;也不考虑产物CO2的吸附),并与实验结果比较。
其中kco,ads、 kco,des分别为CO在Ru的活性位上的吸附速率常数和脱附速率常数,ko2,ads为O2在Ru的活性位上的吸附速率常数。M表示Ru催化剂表面上的活性位。CO在Ru表面活性位上的吸附比O2的吸附强得多。试根据上述反应机理推导CO在催化剂Ru表面上氧化反应的速率方程(不考虑O2的脱附;也不考虑产物CO2的吸附),并与实验结果比较。
3.有关物质的热力学函数(298.15 K)如表5。
表5 物质的热力学数据
物质 | ΔfHm | Sm |
H2 (g) | 0 | 130.59 |
O2(g) | 0 | 205.03 |
H2O (g) | -241.82 | 188.83 |
H2O (l) | -285.84 | 69.94 |
在373.15K,100kPa下,水的蒸发焓Δvap Hm![]() =40.64kJ?mol-1,在298.15~3
=40.64kJ?mol-1,在298.15~3
73.15K间水的等压热容为75.6 J?K-1?mol-1。(1)将上述工艺得到的富氢气体作为质子交换膜燃料电池的燃料。燃料电池的理论效率是指电池所能做的最大电功相对于燃料反应焓变的效率。在298.15K,100 kPa下,当1 molH2燃烧分别生成H2O(l) 和 H2O(g)时,计算燃料电池工作的理论效率,并分析两者存在差别的原因。(2)若燃料电池在473.15 K、100 kPa下工作,其理论效率又为多少(可忽略焓 变和嫡变随温度的变化)?(3)说明(1)和(2)中的同一反应有不同理论效率的原因。
 直接甲醇燃料电池(DMFC ),它属于质子交换膜燃料电池(PEMFC)中之一类,系直接使用水溶液以及蒸汽甲醇为燃料供给能源,而不需通过重组器高温重组甲醇、汽油及天然气等再取出氢以供发电.下列对于该电池的说法正确的是( )
直接甲醇燃料电池(DMFC ),它属于质子交换膜燃料电池(PEMFC)中之一类,系直接使用水溶液以及蒸汽甲醇为燃料供给能源,而不需通过重组器高温重组甲醇、汽油及天然气等再取出氢以供发电.下列对于该电池的说法正确的是( )
 mol
mol
 mol
mol