��Ŀ����
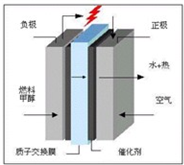
��ѧ��Ԥ�ԣ�ȼ�ϵ�ؽ���21���ͻ�õ��ܵ���Ҫ;���������꿪���ļ״�ȼ�ϵ���Dz��ò����缫����������е����ӽ���Ĥֻ�������Ӻ�ˮ����ͨ�����乤��ԭ����ʾ��ͼ���£�����˵���������

A��a�Ǹ�����b������
B��b���ĵ練Ӧ�ǣ�O2+4H++4e-=2H2O
C���״���a���ϵõ��ӣ�������ԭ��Ӧ
D������·��ͨ��2mol�������ĵ�CH3OHΪ mol
mol
���𰸡�
C
��������

��ϰ��ϵ�д�
 �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д� ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д� ��ʱ�ƿ�������ϰϵ�д�
��ʱ�ƿ�������ϰϵ�д�
�����Ŀ
 CH3OH��g����H1=-116kJ?mol��1
CH3OH��g����H1=-116kJ?mol��1
 ��������ͼ����ָ��ͼ�е�ѹǿP1=
��������ͼ����ָ��ͼ�е�ѹǿP1= CO��g��+2H2��g����Ӧ��ƽ�ⳣ��Ϊ
CO��g��+2H2��g����Ӧ��ƽ�ⳣ��Ϊ