题目内容
(12分)车载甲醇质子交换膜燃料电池(PEMFC)将甲醇蒸气转化为氢气的工 艺有两种:(1)水蒸气变换(重整)法;(2)空气氧化法。两种工艺都得 到副产品CO。
1.分别写出这两种工艺的化学方程式,通过计算,说明这两种工艺的优缺点。有关资料(298 .15K)列于表3。
表3 物质的热力学数据
物质 | ΔfHm | Sm |
CH3OH(g) | -200.66 | 239.81 |
CO2(g) | -393.51 | 213.64 |
CO(g) | -110.52 | 197.91 |
H2O(g) | -241.82 | 188.83 |
H2 (g) | 0 | 130.59 |
2.上述两种工艺产生的少量CO会吸附在燃料电池的Pt或其他贵金属催化剂表面,阻碍H2的吸附和电氧化,引起燃料电池放电性能急剧下降,为此,开发了除去CO的方法。现有一组实验结果(500K)如表4。

表中PCO、PO2 分别为CO和O2的分压;rco为以每秒每个催化剂Ru活性位上所消耗的CO分子数表示的CO的氧化速率。(1)求催化剂Ru上CO氧化反应分别对CO和O2的反应级数(取整数),写出 速率方程。(2)固体Ru表面具有吸附气体分子的能力,但是气体分子只有碰到空活性位才可能发生吸附作用。当已吸附分子的热运动的动能足以克服固体引力场的势垒时,才能脱附,重新回到气相。假设CO和O2的吸附与脱附互不影响,并且表面是均匀的,以θ表示气体分子覆盖活性位的百分数(覆盖度),则气体的吸附速率与气体的压力成正比,也与固体表面的空活性位数成正比。研究提出CO在Ru上的氧化反应的一种机理如下:
 其中kco,ads、 kco,des分别为CO在Ru的活性位上的吸附速率常数和脱附速率常数,ko2,ads为O2在Ru的活性位上的吸附速率常数。M表示Ru催化剂表面上的活性位。CO在Ru表面活性位上的吸附比O2的吸附强得多。试根据上述反应机理推导CO在催化剂Ru表面上氧化反应的速率方程(不考虑O2的脱附;也不考虑产物CO2的吸附),并与实验结果比较。
其中kco,ads、 kco,des分别为CO在Ru的活性位上的吸附速率常数和脱附速率常数,ko2,ads为O2在Ru的活性位上的吸附速率常数。M表示Ru催化剂表面上的活性位。CO在Ru表面活性位上的吸附比O2的吸附强得多。试根据上述反应机理推导CO在催化剂Ru表面上氧化反应的速率方程(不考虑O2的脱附;也不考虑产物CO2的吸附),并与实验结果比较。
3.有关物质的热力学函数(298.15 K)如表5。
表5 物质的热力学数据
物质 | ΔfHm | Sm |
H2 (g) | 0 | 130.59 |
O2(g) | 0 | 205.03 |
H2O (g) | -241.82 | 188.83 |
H2O (l) | -285.84 | 69.94 |
在373.15K,100kPa下,水的蒸发焓Δvap Hm![]() =40.64kJ?mol-1,在298.15~3
=40.64kJ?mol-1,在298.15~3
73.15K间水的等压热容为75.6 J?K-1?mol-1。(1)将上述工艺得到的富氢气体作为质子交换膜燃料电池的燃料。燃料电池的理论效率是指电池所能做的最大电功相对于燃料反应焓变的效率。在298.15K,100 kPa下,当1 molH2燃烧分别生成H2O(l) 和 H2O(g)时,计算燃料电池工作的理论效率,并分析两者存在差别的原因。(2)若燃料电池在473.15 K、100 kPa下工作,其理论效率又为多少(可忽略焓 变和嫡变随温度的变化)?(3)说明(1)和(2)中的同一反应有不同理论效率的原因。
1.化学方程式:
甲醇水蒸气变换(重整)的化学反应方程式为:
CH3OH(g)+H2O(g)=CO2(g)+3H2(g) (1) (1分)
甲醇部分氧化的化学反应方程式为:
CH3OH(g)+![]() O 2 (g)=CO2(g)+2H2(g) (2) (1分)
O 2 (g)=CO2(g)+2H2(g) (2) (1分)
以上两种工艺都有如下副反应:
CO2(g)+H2(g)= CO(g)+H2O(g) (3) (1分)
反应(1)、(2)的热效应分别为:
ΔfHm![]() (1)=(-393.51+200.66+241.82)kJ?mol-1=48.97 kJ?mol-1 (1分)
(1)=(-393.51+200.66+241.82)kJ?mol-1=48.97 kJ?mol-1 (1分)
ΔfHm![]() (2)=(-393.51+200.66)kJ?mol-1=-192.85 kJ?mol-1 (1分)
(2)=(-393.51+200.66)kJ?mol-1=-192.85 kJ?mol-1 (1分)
上述热力学计算结果表明,反应(1)吸热,需要提供一个热源,这是其缺点;反应(1)的H2收率高,这是其优点。反应(2)放热,可以自行维持,此为优点;反应(2)的氏收率较低,且会被空气(一般是通人空气进行氧化重整)中的N2所稀释,因而产品中的H2浓度较低,此为其缺点。(2分)
2.(1)CO的氧化反应速率可表示为:![]() ⑷(1分)
⑷(1分)
将式(4)两边取对数,有![]()
将题给资料分别作![]() 图,得两条直线,其斜率分别为:
图,得两条直线,其斜率分别为:
α≈-1(1分)β≈1(1分)
另解:pco保持为定值时,将两组实验资料( rco、pO2)代人式⑷,可求得
一个β值,将不同组合的两组实验资料代人式⑷,即可求得几个β值,取
其平均值,得β≈1(若只计算1个β值,扣0.5分)
同理,在保持pO2为定值时,将两组实验资料(rco, pco)代人式⑷,可求得
一个α值,将不同组合的两组实验资料代人式⑷,即可求得几个α值,取
其平均值,得α≈-1(若只计算1个α值,扣0 .5分)
因此该反应对CO为负一级反应,对O2为正一级反应,速率方程为:![]() (1分)
(1分)
(2)在催化剂表面,各物质的吸附或脱附速率为:
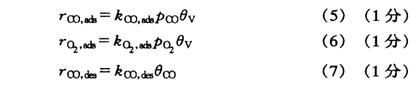
式中θv, θco分别为催化剂表面的空位分数、催化剂表面被CO分子占有的
分数。表面物种O-M达平衡、OC-M达吸附平衡时,有:
![]() ⑻(2分)
⑻(2分) ![]() ⑼(1分)
⑼(1分)
于是,有![]() ⑽,
⑽,
![]()
k为CO在催化剂Ru活性位的氧化反应的表观速率常数。
由于CO在催化剂表面吸附很强烈,即有θco≈1,在此近似下,由式⑽得到:![]() ⑾ (1分)
⑾ (1分)
上述导出的速率方程与实验结果一致。
另解:CO和O2吸附于催化剂Ru的活性位上,吸附的CO与吸附的O2之间的表面反应为速率控制步骤,则可推出下式:
![]() (4分)
(4分)
上式中的k、kco、ko2是包含kco,ads、ko2,ads、kco,des等参数的常数。
根据题意,在Ru的表面上,CO的吸附比O2的吸附强得多,则有
ko2Po2≈0 (1分),kcoPco>>1(1分)
于是上式可简化为式⑾,即:rco=kPo2/Pco
按上述推导,同样给分。
3.(1)H2(g)+![]() O2(g)→H2O(l) (1)
O2(g)→H2O(l) (1)
298.15 K时上述反应的热力学函数变化为:
ΔrHm![]() (1)= -285.84 kJ?mol-1 (1分)
(1)= -285.84 kJ?mol-1 (1分)
ΔrSm![]() (1)=(69.94-130.59-205.03/2)J?K-1?mol-1=-163.17 J?K-1?mol-1
(1)=(69.94-130.59-205.03/2)J?K-1?mol-1=-163.17 J?K-1?mol-1
(1分)
ΔrGm![]() (1)=ΔrHm
(1)=ΔrHm![]() (1)-TΔrSm
(1)-TΔrSm![]() (1)
(1)
=(-285.84+298.15×163.17×10-3)kJ?mol-1=-237.19 kJ?mol-1(1分)
燃料电池反应(1)的理论效率为:![]() (1分)
(1分)
H2(g)+![]() O2(g)→H2O(g) (2)
O2(g)→H2O(g) (2)
反应(2)的热力学函数变化为:![]() (1分)
(1分)
![]()

燃料电池反应(2)的理论效率为:![]() (1分)
(1分)
两个反应的ΔrGm![]() (1)与ΔrGm
(1)与ΔrGm![]() (2)相差不大,即它们能输出的最大电能相近;然而,这两个反应的热函变化ΔrHm
(2)相差不大,即它们能输出的最大电能相近;然而,这两个反应的热函变化ΔrHm![]() (1)与ΔrHm
(1)与ΔrHm![]() (2)相差大,有:
(2)相差大,有:
ΔΔH=ΔrHm![]() (2)-ΔrHm
(2)-ΔrHm![]() (1)=44.01 kJ?mol-1
(1)=44.01 kJ?mol-1
上述热函变化差ΔΔH恰好近似为图5流程的热函变化:
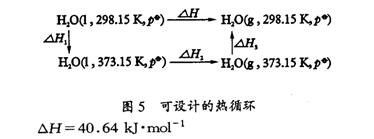
上述结果表明,由于两个燃烧反应的产物不同,所释放的热能(热函变化)也不同,尽管其能输出的最大电能相近,但其燃料电池的理论效率仍然相差较大。(2分)
(2)在473.15 K下,对于反应(2),有:
ΔrHm![]() (2)= -241.82 kJ?mol-1 (1分)
(2)= -241.82 kJ?mol-1 (1分)
ΔrSm![]() (2)= -44.28J?K-1?mol-1 (1分)
(2)= -44.28J?K-1?mol-1 (1分)
ΔrGm![]() (2)=ΔrHm
(2)=ΔrHm![]() (2)-TΔrSm
(2)-TΔrSm![]() (2)=-220.88 kJ?mol-1(1分)
(2)=-220.88 kJ?mol-1(1分)
∴η(2)=ΔrGm![]() (2)/ΔrHm
(2)/ΔrHm![]() (2)=91.3%(1分)
(2)=91.3%(1分)
(3)比较(1)和(2)的计算结果,说明燃料电池的理论效率是随其工作温度而变化的,随着温度降低,其理论效率升高。反应的ΔrGm![]() 随温度而变化,ΔrGm
随温度而变化,ΔrGm![]() 随温度的变化主要是由TΔrSm
随温度的变化主要是由TΔrSm![]() 引起的。(2分)
引起的。(2分)

 阅读快车系列答案
阅读快车系列答案(7分)德国克莱斯公司成功研制了利用甲醇车载制氢氧燃料电池工艺,其原理如右图所示,请观察此图回答: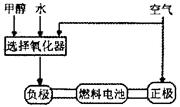
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=" +" 49.0 kJ·mol-1
②2CH3OH(g)+O2(g)=2CO2(g)+4H2(g);△H=-385.8kJ·mol-1
下列说法正确的是
| A.反应①中反应物的总能量高于生成物的总能量 |
| B.反应①中拆开CH3OH(g)和H2O(g)中的化学键所需能量大于形成CO2(g)和3H2(g)中的化学键所释放的能量 |
| C.CH3OH蒸气的燃烧热为大于192.9 kJ·mol-1 |
| D.根据②推知反应:2CH3OH(l)+ O2(g)=2CO2(g)+4H2(g)的△H>-385.8kJ·mol-1 |
(3)可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如右图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。b处通入的物质是 ,负极反应为: 。
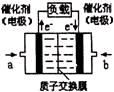
 德国克莱斯公司成功研制了利用甲醇车载制氢氧燃料电池工艺,其原理如图1所示,请观察此图回答:
德国克莱斯公司成功研制了利用甲醇车载制氢氧燃料电池工艺,其原理如图1所示,请观察此图回答:
